
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
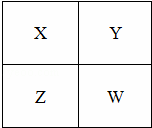
|
| A. | Z元素的原子半径可能比Y元素的小 |
|
| B. | W的原子序数可能是Y的原子序数的2倍 |
|
| C. | W的气态氢化物的稳定性一定比Y的强 |
|
| D. | Z的化学活泼性一定比X强 |
| 位置结构性质的相互关系应用.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | X、Y、Z、W四种短周期元素,由在周期表中的相对位置可知,X、Y为第二正确元素,Z、W为第三周期元素. A、根据电子层数来比较原子的半径; B、若Y为O,W为S,则符合; C、非金属性越强,氢化物越稳定,根据非金属性的递变规律分析; D、元素可能为金属或非金属判断,如是金属,自上而下活泼性逐渐增强,如是非金属,自上而下活泼性逐渐减弱. |
| 解答: | 解:A、为主族元素,原子核外电子层数越多,半径越大,则Z元素的原子半径一定比Y元素的大,故A错误; B、若Y为O,原子序数为8,W为S,原子序数为16,则符合,故B正确; C、同主族元素,从上到下元素的非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则W的气态氢化物的稳定性一定比Y的弱,故C错误; D、若Z、X是非金属元素,则Z的化学活泼性比X弱,若Z、X是金属元素,则Z的化学活泼性比X强,故D错误; 故选B. |
| 点评: | 本题考查位置结构性质的相互关系应用,难度不大,注意元素周期律的递变规律的应用. |


科目:高中化学 来源: 题型:
下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银 ②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
A.只有①③ B.只有②③ C.只有③④ D.只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

|
| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
|
| B. | 实验仪器D可以起到防止溶液倒吸的作用 |
|
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
|
| D. | 若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液不变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
根据上述实验,以下说法正确的是( )
|
| A. | 原混合物中一定含有Fe2O3 |
|
| B. | 气体A一定均为纯净物 |
|
| C. | 气体C是纯净的氯气 |
|
| D. | 溶液甲中一定含有K2S、K2SO3、NaNO2、K2SO4可能含有KAlO2、K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA代表阿伏加德罗常数.下列说法正确的是( )
|
| A. | 9g重水(D2O)中所含质子数为0.5×6.02×1023 |
|
| B. | 电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
|
| C. | 往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
|
| D. | VL a mol•L﹣1的氯化铁溶液中,若Fe3+的数目为NA,则Cl﹣的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是
( )
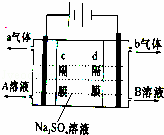
|
| A. | c隔膜为阴离子交换膜、d隔膜为阳离子交换膜 |
|
| B. | A溶液为硫酸,B溶液为氢氧化钠 |
|
| C. | a气体为氢气,b气体为氧气 |
|
| D. | 该电解反应的总方程式为:2Na2SO4+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与能源、环境、生产、生活密切相关.下列说法不正确的是( )
|
| A. | CO2和氟氯烃等物质的大量排放会造成温室效应的加剧 |
|
| B. | 可利用工业生产产生的二氧化碳制造全降解塑料 |
|
| C. | 世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
|
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10﹣9 | 6.8×10﹣6 | 5.5×10﹣6 | 1.8×10﹣11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 不能 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 贝壳研磨成粉末仍是CaCO3,由于CaCO3比MgCO3还要难溶,所以将其直接投入海水中不能产生MgCO3 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 CaCO3\frac{\underline{\;高温\;}}{\;}CaO+CO2↑ .
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 可以 (填“可以”或“不可以”)得到Mg(OH)2.在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 能 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 Mg2++CO32﹣=MgCO3 MgCO3+2OH﹣=Mg(OH)2+CO32﹣ .(用离子方程式表示)
(3)已知海水中镁离子浓度为1.8×10﹣3mol/L,则要使镁离子产生沉淀,溶液的pH最低应为 10 .
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是
A.Na+、Ca2+、Cl-、SO42-
B.Fe2+、H+ 、SO32-、ClO-
C.Mg2+、NH4+、Cl- 、SO42-
D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com