
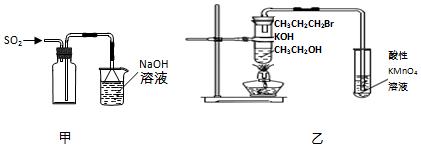
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
分析 A.二氧化硫的密度大于空气,应该采用向上排空气法收集;
B.乙醇易挥发,挥发出的乙醇能够使酸性高锰酸钾溶液褪色,干扰了检验结果;
C.中和滴定中,眼睛应该注视锥形瓶中溶液颜色变化;
D.俯视定容,加入蒸馏水体积偏小.
解答 解:A.二氧化硫的密度比空气答,收集SO2气体的导管应该采用长进短出的方式,故A错误;
B.制取的丙烯中含有乙醇,乙醇也能够使酸性高锰酸钾溶液褪色,干扰了烯烃的检验,可用溴水检验,故B错误;
C.酸碱中和滴定过程中,眼睛必须注视锥形瓶中溶液颜色变化,以便及时判断滴定终点,不需要观察滴定管刻度的变化,故C错误;
D.配制溶液定容时,俯视容量瓶刻度会使加入蒸馏水体积偏小,所配溶液体积偏小,根据c=$\frac{n}{V}$可知所得溶液的浓度偏高,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,涉及气体制备与收集、烯烃检验、中和滴定、溶液配制等知识,明确常见化学实验基本操作方法即可解答,试题有利于提高学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.| A. | 电极a的反应式为:CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极a流向电极b | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b | |
| D. | 当固体电解质中有2 mol O2-通过时,外电路通过电子8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维导电能力很强,是一种很好的通讯材料 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
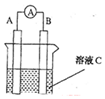 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |
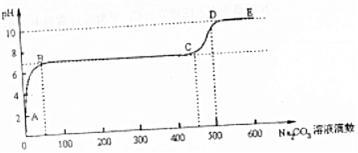
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com