
【题目】关于![]() 说法正确的是( )
说法正确的是( )
A.同一条直线上碳原子有6个
B.所有原子可能在同一平面上
C.同一平面上的原子最多有19个
D.所有碳原子不可能在同一平面上
【答案】C
【解析】
根据甲烷的正四面体结构、乙烯平面结构、乙炔的直线型结构、苯的平面结构分析判断,需要注意碳碳单键可以旋转。
A.苯环是平面正六边形,两个基团处于苯环的对位位置,碳碳三键为直线结构,连接苯环的碳碳双键的碳原子处于苯中氢原子位置,所以有5个碳原子共线(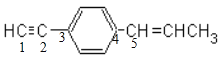 ),故A错误;
),故A错误;
B.分子中存在甲基,甲基具有甲烷的四面体结构,所有原子不可能都在同一平面,故B错误;
C.苯环和碳碳双键是平面结构,乙炔的直线型结构,该三种结构可能共平面,甲基具有甲烷的四面体结构,甲基中的碳原子和1个氢原子可能位于该平面,因此同一平面上的原子最多有19个,故C正确;
D.甲基碳原子处于碳碳双键平面内,碳碳三键的直线结构处于苯环的平面内,碳碳双键平面与苯环平面,可以通过碳碳单键的旋转,使2个平面重合,所以最多有11个碳原子共面,即所有碳原子可能在同一平面上,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
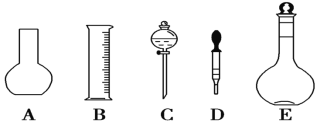
(2)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.3 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.3 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素,请回答下列问题:
⑴基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
⑵Co能形成[Co(CNO)6]3-
①1 mol该离子中含有δ键的数目为________。
②与CNO-互为等电子体的分子为________(填化学式,任写一种)。
③相同压强下,CO晶体的熔点高于N2晶体的原因是________。
⑶氟硼酸铵(NH4BF4)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等.是合成氮化硼纳米管的原料之一。
①1 mol NH4BF4含有_______ mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为________(用元素符号表示)。
③BF4-的空间立体构型为________,其中硼原子的杂化轨道类型为________。
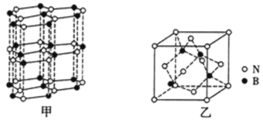
④BN晶体有多种结构,其中六方相氮化硼![]() 如图甲
如图甲![]() 是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(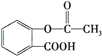 )是常用的解热镇痛药,下列说法不正确的是( )
)是常用的解热镇痛药,下列说法不正确的是( )
A.1mol阿司匹林可以与3molNaOH反应
B.阿司匹林与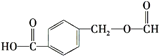 互为同分异构体
互为同分异构体
C.阿司匹林可以发生取代反应、加成反应、酯化反应
D.1mol阿司匹林可以与5molH2发生加成反应,也可与1mol碳酸氢钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据![]() 科技日报
科技日报![]() 报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成含氧化合物。
请回答下列问题:
⑴在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该原子的外围电子排布式为____________。
⑵在第四周期过渡金属中,基态原子第一电离能最大的元素是___________(填元素符号)。
⑶铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________________。
⑷常温下,H2O2氧化CH4生成CH3OH、HCHO、 HCOOH等。
①CH3OH、HCHO、 HCOOH的沸点分别为64.7℃、-195℃、100.8℃,其主要原因是____________________;
②CH4和HCHO比较,键角较大的是_________,该分子的空间构型为____________。
⑸配离子中受配体的影响,中心离子同能级d轨道的能量不同,人们把1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量称为d的分裂能,用符号![]() 表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”
表示。分裂能大小一般与配体种类和中心离子所带电荷数有关。据此判断分裂能Δ[Co(H2O)6]2+________Δ[Co(H2O)6]3+(填“>”“<”或“=”![]() ,理由是____________。
,理由是____________。
⑹钴晶胞和白铜(铜镍合金)晶胞如图所示。
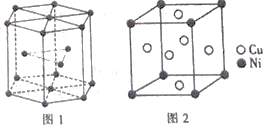
①钴晶胞堆积方式的名称为____________;
②已知白铜晶胞的密度为dgcm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为____________pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值![]() 表示
表示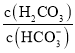 或
或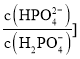 与pH的关系如图所示。已知碳酸
与pH的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]()
![]() 。则下列说法不正确的是( )
。则下列说法不正确的是( )
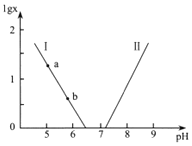
A.曲线Ⅱ表示 与pH的变化关系
与pH的变化关系
B.![]() 的过程中,水的电离程度逐渐增大
的过程中,水的电离程度逐渐增大
C.当![]()
![]() 时,
时,![]()
D.当pH增大时,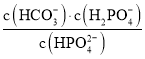 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)钠元素的焰色反应呈黄色,其中黄色对应的辐射波长为______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)C、H、N、O四种元素中电负性最大的是______![]() 填元素符号
填元素符号![]() ,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
(3)![]() 的沸点比
的沸点比![]() ______
______![]() 填“高”或“低”
填“高”或“低”![]() ;原因是______。
;原因是______。
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为______nm;MnO也属于NaCl型结构,晶胞参数为a’=0.448nm,则r(Mn2+)为______nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理饮食和正确使用药物能保证身心健康,这些都离不开化学。
(1)维生素是参与生物生长发育和新陈代谢所必需的一类小分子有机化合物;我们所熟悉的维生素有A、B、C、D、E等。其中维生素C又称___________________;其水溶液显______性,它能使酸性高锰酸钾溶液褪色,具有较强的_______性。
(2)某同学一天的食谱为:米饭、烙饼、豆腐、鸡蛋、糖醋排骨、酱牛肉。你认为这位同学还应该吃一些_________________食物,营养才算平衡。
(3)人们熟知的一种解热镇痛药阿司匹林的结构式为: 。请你写出其中含有的一种官能团的名称__________。阿司匹林属于____________(填有机物,无机物,氧化物)
。请你写出其中含有的一种官能团的名称__________。阿司匹林属于____________(填有机物,无机物,氧化物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com