

| A. | 图①装置可验证酸性:H2CO3>H2SiO3 | |
| B. | 图②装置可用于收集气体H2 CO2 Cl2 NH3 | |
| C. | 图③装置可用于分离CCl4萃取碘水后的有机层和水层 | |
| D. | 图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出 |
分析 A.盐酸易挥发,不能排除盐酸的影响;
B.H2、CO2、Cl2、NH3都可用排空法收集,CO2、Cl2用向上排空法,H2、NH3用向下排空法;
C.四氯化碳和水互不相溶,可用分液的方法分离;
D.形成原电池反应,锌为负极.
解答 解:A.盐酸易挥发,不能排除盐酸的影响,可用稀硫酸代替盐酸,故A错误;
B.H2、CO2、Cl2、NH3都可用排空法收集,CO2、Cl2用向上排空法,可从长导管进气,H2、NH3用向下排空法,可从短导管进气,故B正确;
C.四氯化碳和水互不相溶,可用分液的方法分离,故C正确;
D.锌比铜活泼,形成原电池反应,锌为负极,正极生成氢气,故D正确.
故选A.
点评 本题考查较为综合,涉及气体的制备、物质的分离、金属的腐蚀等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | CH4和Cl2混合于试管中光照,颜色逐渐褪去 | 二者发生了化合反应 |
| B | 微热滴有2滴酚酞的饱和NaHCO3溶液,溶液颜色加深 | NaHCO3受热分解生成了Na2CO3 |
| C | 向淀粉溶液中加入20%的硫酸,加热几分钟,冷却后再加入银氨溶液,水浴,没有银镜生成 | 淀粉没发生水解 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀硫酸,观察到试管口有红棕色气体产生 | 酸性环境下,NO3-被Fe2+还原为NO,NO遇氧气生成NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lH、2H、3H为同素异形体 | B. | lH、2H、3H互为同位素 | ||
| C. | lH、2H、3H的质量数相同 | D. | lH、2H、3H为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
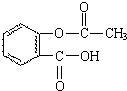 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
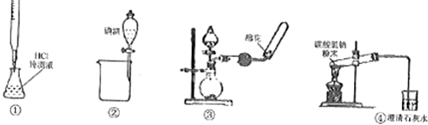
| A. | 利用装置①进行盐酸待测溶液浓度的测定 | |
| B. | 利用装置②分离碘酒中碘和酒精 | |
| C. | 利用装置③制备收集干燥氨气 | |
| D. | 利用装置④加热分解碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离常数如表,则2NaF+H3PO4═2HF+Na2HPO4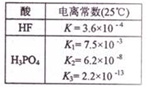 | |
| B. | 以金属铜为电极电解饱和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| D. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
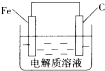 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com