
| A. | 甲烷和氯气在室温下的黑暗环境中不可以稳定存在 | |
| B. | 将乙烯和乙烷气体分别通入溴的四氯化碳溶液中前者褪色,后者不褪色 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中 |
分析 A.甲烷与氯气的反应应在光照条件下进行;
B.乙烯含碳碳双键,能与溴水反应;
C.苯和溴水不反应;
D.乙烯被氧化生成二氧化碳气体.
解答 解:A.甲烷与氯气的反应应在光照条件下进行,在黑暗处可稳定存在,故A错误;
B.乙烯含碳碳双键,能与溴水反应,乙烷不能,故B正确;
C.苯性质稳定,与溴水不反应,苯能使溴水褪色是因为发生萃取,为物理过程,故C错误;
D.乙烯被氧化生成二氧化碳气体,引入新杂质,应用溴水除杂,故D错误.
故选B.
点评 本题考查较为综合,涉及有机物的结构和性质、有机物的分离和鉴别等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意除杂时不能引入新的杂质,难度不大.


科目:高中化学 来源: 题型:解答题
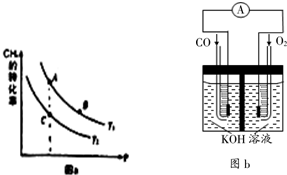 H2、CH3OH是优质的清洁燃料,可制作燃料电池.
H2、CH3OH是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝在空气中不易被腐蚀 | |
| B. | 铁制器件在潮湿空气中生锈 | |
| C. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| D. | 远洋海轮的外壳连接锌块可保护轮船不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
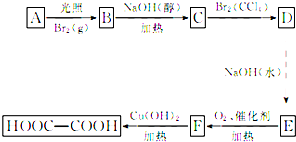 草酸(HOOC-COOH)是一种重要的化工原料和化工产品.利用石油化工产品中的烷烃可以生成草酸,生产流程如下:已知上述框图中有机物B的相对分子质量比有机物A的相对分子质量大79.请回答下列问题:
草酸(HOOC-COOH)是一种重要的化工原料和化工产品.利用石油化工产品中的烷烃可以生成草酸,生产流程如下:已知上述框图中有机物B的相对分子质量比有机物A的相对分子质量大79.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe为正极 | B. | Cu为负极 | ||
| C. | 负极发生还原反应 | D. | 电解质溶液是CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
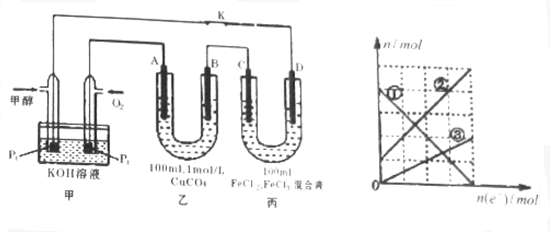
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
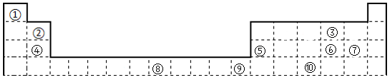
 .元素⑨的基态原子的价电子排布式为1s22s22p63s23p63d104s2.
.元素⑨的基态原子的价电子排布式为1s22s22p63s23p63d104s2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com