
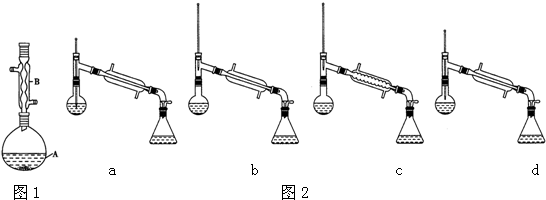
 实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:分析 (1)根据a、b装置的不同点进行解答;
(2)根据相关数据计算,加热时烧瓶内液体的体积应小于烧瓶容积;
(3)从冷凝的原理出发解答;
(4)根据该反应过程发生的副反应及反应产物分析;
(5)溴乙烷中含有单质溴显棕黄色,根据溴单质的性质选择除杂试剂;根据分离互不相溶的液体的操作分析;
(6)已知n(乙醇)=0.25mol,然后根据方程式结合转化率来解答;
(7)溴乙烷在碱性条件下水解生成乙醇和NaBr,中和多余的碱,然后用硝酸银检验溴离子.
解答 解:(1)由题给信息,知该反应为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,反应需要加热,所以应采用装置a,
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的$\frac{2}{3}$,
V(C2H5OH)=$\frac{0.25mol×46g/mol}{0.80g/c{m}^{3}}$=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出.
故答案为:B;
(4)可能发生的副反应有:C2H5OH$→_{140℃}^{浓硫酸}$C2H4↑+H2O,2C2H5OH $→_{140℃}^{浓硫酸}$C2H5OC2H5+H2O,2HBr+H2SO4(浓)$\stackrel{△}{→}$Br2+SO2↑+2H2O等,
则反应产物混合液中含有C2H5Br、C2H5OC2H5和Br2,所以将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
故答案为:C2H5Br、C2H5OC2H5和Br2;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗;
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35;
(7)溴乙烷与氢氧化钠溶液混合加热,溴乙烷水解生成乙醇和NaBr,然后加硝酸中和多余的碱,再向溶液中加硝酸银,生成浅黄色沉淀,说明含有溴离子,即溴乙烷中含有溴元素,所以正确的操作顺序是④①⑤③②;
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,侧重于实验制备方案设计、物质的分离提纯、有关方程式的计算等,注意掌握相关物质的基本化学性质、明确实验目的是解答本题的关键,平时须注意积累相关反应知识,题目难度中等.


科目:高中化学 来源: 题型:解答题
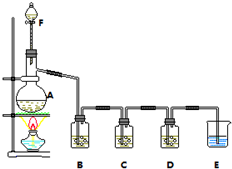 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
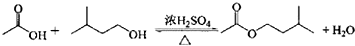
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤①③④ | B. | ①③⑤②④ | C. | ①②③④⑤ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
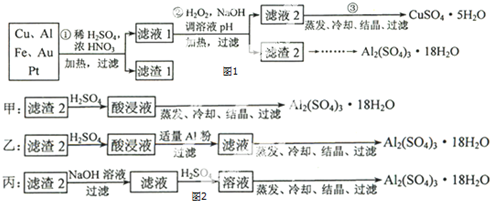
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com