
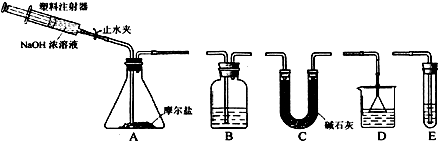
分析 (1)可用KSCN检验Fe3+,由溶液制备晶体,可进行蒸发浓缩、冷却结晶、过滤等操作;
(2)莫尔盐与氢氧化钠溶液反应生成氨气,可用稀硫酸吸收,注意防止倒吸,氢氧化钠具有强腐蚀性,可与二氧化硅反应;
(3)加入氢氧化钠溶液时,应先打开止水夹,缓慢推压注射器活塞,用稀硫酸吸收氨气,为保证气体完全吸收,可用注射器向A中注入空气;
(4)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,生成的m(NH3)=0.68g,m(Fe2O3)=1.6g,以此可确定SO42-的质量以及n(NH4+):n(Fe2+):n((SO42-):n(H2O)的比值.
解答 解:(1)可用KSCN检验Fe3+,如含Fe3+,则加入KSCN,溶液变为血红色,由溶液制备晶体,可进行蒸发浓缩、冷却结晶、过滤等操作,
故答案为:KSCN溶液;蒸发浓缩;冷却结晶;
(2)莫尔盐与氢氧化钠溶液反应生成氨气,生成氨气先用碱石灰干燥,以除去水,然后用稀硫酸在D装置内吸收氨气,以防止倒吸,氢氧化钠具有强腐蚀性,可与二氧化硅反应,则可用注射器加入氢氧化钠溶液,
故答案为:C、D; NaOH溶液对分液漏斗活塞、旋塞的磨口腐蚀性强;
(3)加入氢氧化钠溶液时,应先打开止水夹,缓慢推压注射器活塞,用稀硫酸吸收氨气,为保证气体完全吸收,可用注射器向A中注入空气,使装置中的氨气全部进入吸收液,
故答案为:打开止水夹,缓慢推压注射器活塞;H2SO4溶液;用注射器向A中注入空气,使装置中的氨气全部进入吸收液;
(4)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,
生成的m(NH3)=0.68g,m(Fe2O3)=1.6g,
则n(NH3)=$\frac{0.68g}{17g/mol}$=0.04mol,n(Fe2O3)=$\frac{1.6g}{160g/mol}$=0.01mol,
则m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,
则m(SO42-)=7.84g-2.16g-0.72g-1.12g=3.84g,
n(SO42-)=$\frac{3.84g}{96g/mol}$=0.04mol,
所以n(NH4+):n(Fe2+):n((SO42-):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,
故答案为:3.84;2:1:2:6.
点评 本题考查物质的含量测定,侧重于学生的分析能力、计算能力和实验能力的考查,题目难度中等,注意把握相关实验基本方法和注意事项.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ga(OH)3酸性强于Al(OH)3 | B. | Al(OH)3酸性强于Ga(OH)3 | ||
| C. | Ga(OH)3碱性强于Al(OH)3 | D. | Al(OH)3碱性强于Ga(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是实验室制取并探究氯气化学性质的装置图
如图是实验室制取并探究氯气化学性质的装置图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3 mol | C. | 2.5mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2c(H+)═2c(HS-)+c(S2-)+2c(OH-)? | B. | c(H+)═c(HS-)+2c(S2-)+c(OH-) | ||
| C. | c(H+)═c(HS-)+2c(S2-)? | D. | c(H+)═2c(S2-)+c(OH-)? |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
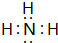 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程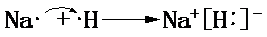 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
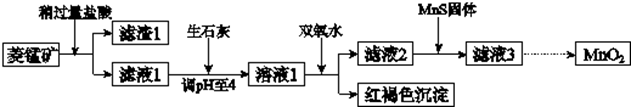
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
| 化学式 | FeS | CuS | MnS |
| 溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气混合并光照 | B. | 乙醇和酸性高锰酸钾溶液的反应 | ||
| C. | 乙烯生成聚乙烯 | D. | 苯和氢气反应生成环己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com