
 .
. .
. .
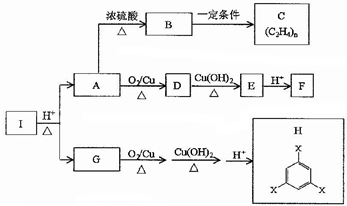
. 分析 A能发生催化氧化反应,且在浓硫酸的作用下发生消去反应生成乙烯,则A为乙醇,含有醇羟基,B为乙烯,乙烯发生加聚反应生成聚乙烯,乙醇发生催化氧化生成乙醛,乙醛与氢氧化铜悬浊液反应生成乙酸钠,酸化后得到乙酸,反应方程式为 ,乙烯与氧气反应生成环氧乙烷,反应方程式为:
,乙烯与氧气反应生成环氧乙烷,反应方程式为: ;1.96gG完全燃烧生成二氧化碳和水的总质量为4.68g,通过浓硫酸增重0.72g,则二氧化碳的质量为3.96g,物质的量为0.09mol;水的物质的量为0.04mol;含碳的质量和氢的质量之和为12×0.09+0.08=1.16g,则含氧的质量为1.96-1.16=0.8g;C、H、O的物质的量之比为9:8:5,则G的分子式为C9H8O5;
;1.96gG完全燃烧生成二氧化碳和水的总质量为4.68g,通过浓硫酸增重0.72g,则二氧化碳的质量为3.96g,物质的量为0.09mol;水的物质的量为0.04mol;含碳的质量和氢的质量之和为12×0.09+0.08=1.16g,则含氧的质量为1.96-1.16=0.8g;C、H、O的物质的量之比为9:8:5,则G的分子式为C9H8O5;
化合物I中含有13个碳原子,化合物G含有9个碳原子,则和2mol乙醇反应,故G中含有2个-COOH,催化氧化后能与氢氧化铜反应说明含有醇羟基,故化合物H含有3个羧基,化合物H的结构简式为 .
.
解答 解:A能发生催化氧化反应,且在浓硫酸的作用下发生消去反应生成乙烯,则A为乙醇,含有醇羟基,B为乙烯,乙烯发生加聚反应生成聚乙烯,乙醇发生催化氧化生成乙醛,乙醛与氢氧化铜悬浊液反应生成乙酸钠,酸化后得到乙酸,反应方程式为 ,乙烯与氧气反应生成环氧乙烷,反应方程式为:
,乙烯与氧气反应生成环氧乙烷,反应方程式为: ;1.96gG完全燃烧生成二氧化碳和水的总质量为4.68g,通过浓硫酸增重0.72g,则二氧化碳的质量为3.96g,物质的量为0.09mol;水的物质的量为0.04mol;含碳的质量和氢的质量之和为12×0.09+0.08=1.16g,则含氧的质量为1.96-1.16=0.8g;C、H、O的物质的量之比为9:8:5,则G的分子式为C9H8O5;
;1.96gG完全燃烧生成二氧化碳和水的总质量为4.68g,通过浓硫酸增重0.72g,则二氧化碳的质量为3.96g,物质的量为0.09mol;水的物质的量为0.04mol;含碳的质量和氢的质量之和为12×0.09+0.08=1.16g,则含氧的质量为1.96-1.16=0.8g;C、H、O的物质的量之比为9:8:5,则G的分子式为C9H8O5;
化合物I中含有13个碳原子,化合物G含有9个碳原子,则和2mol乙醇反应,故G中含有2个-COOH,催化氧化后能与氢氧化铜反应说明含有醇羟基,故化合物H含有3个羧基,化合物H的结构简式为 .
.
(1)A为乙醇,含有羟基官能团,B为乙烯,乙烯发生加聚反应生成聚乙烯C,故答案为:羟基;加聚反应;
(2)乙醇发生催化氧化生成乙醛,乙醛与氢氧化铜悬浊液反应生成乙酸钠,酸化后得到乙酸,反应方程式为 故答案为:
故答案为: ;
;
(3)乙烯与氧气反应生成环氧乙烷,反应方程式为: ,故答案为:
,故答案为: ;
;
(4)1.96gG完全燃烧生成二氧化碳和水的总质量为4.68g,通过浓硫酸增重0.72g,则二氧化碳的质量为3.96g,物质的量为0.09mol;水的物质的量为0.04mol;含碳的质量和氢的质量之和为12×0.09+0.08=1.16g,则含氧的质量为1.96-1.16=0.8g;C、H、O的物质的量之比为9:8:5,则G的分子式为C9H8O5,故答案为:C9H8O5;
(5)化合物I中含有13个碳原子,化合物G含有9个碳原子,则和(2分)子乙醇反应,故G中含有2个-COOH,催化氧化后能与氢氧化铜反应说明含有醇羟基,故化合物H含有3个羧基,化合物H的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的结构和性质,官能团之间的衍变关系,有机反应类型等知识点,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
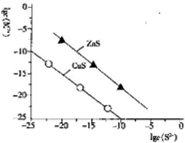
| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时K甲(CuS)均为1×10-28 | |
| C. | 向l00mLZn2+、Cu2+均为10-5mol•L-1 的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1工业废水中加入ZnS粉末,会有CuS沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | pH=2、温度为50℃、10 min时,X的物质的量浓度c( X)为5.6×10-4mol•L-1 | |
| B. | 图2说明:任何条件下X降解率均随温度升高先增后减 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | 图1说明:50℃时,X的降解率随溶液PH的增大而逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He分别含有1和2个质子 | |
| C. | ${\;}_{2}^{3}$He 和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{3}$He的最外层电子数为1,所以${\;}_{2}^{3}$He 具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
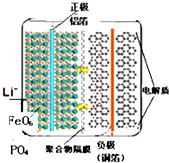
| A. | 放电时,铝箔所在电极为负极,铜箔所在电极为正极 | |
| B. | 放电时,电池反应式为:FePO4+Li═LiFePO4 | |
| C. | 充电时,Li+向阴极移动 | |
| D. | 充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
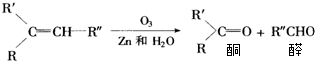
| A. |  | B. | 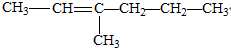 | ||
| C. | 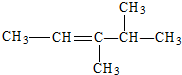 | D. | 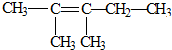 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应的过程,本质上是旧化学键断裂和新化学键形成的过程 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 原子中核外电子排布的周期性变化是产生元素周期律的根本原因 | |
| D. | 核素就是同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com