
| A. | 原子半径大小为W>X>Z>Y | |
| B. | X、Y、Z的氢化物的水溶液均呈酸性 | |
| C. | W与Y形成的三原子化合物既含极性共价键又含非极性共价键 | |
| D. | Z元素的最高价氧化物对应的水化物酸性最强 |
分析 W的一种单质是自然界中最硬的物质,为金刚石,W为C元素,工业上采用液态空气分馏方法来生产X的单质,且X单质化学性质不活泼,则X为N元素,Y、Z阴离子的核外电子数与氩原子电子数相同,Y、Z应为第三周期元素,且Y原子最外层电子数是其电子层数的2倍,Y为S元素,则Z为Cl元素,以此解答该题.
解答 解:W的一种单质是自然界中最硬的物质,为金刚石,W为C元素,工业上采用液态空气分馏方法来生产X的单质,且X单质化学性质不活泼,则X为N元素,Y、Z阴离子的核外电子数与氩原子电子数相同,Y、Z应为第三周期元素,且Y原子最外层电子数是其电子层数的2倍,Y为S元素,则Z为Cl元素,
A.同周期元素从左到右元素的原子半径逐渐减小,原子核外电子层数越多,原子半径越大,则应为S>Cl>C>N,故A错误;
B.氨气水溶液呈碱性,故B错误;
C.W与Y形成的三原子化合物为CS2,只含有极性共价键,故C错误;
D.对应元素中Cl元素的非金属性最强,则对应的最高价氧化物对应的水化物酸性最强,故D正确.
故选D.
点评 本题主要考查了元素周期律、原子结构、元素化合物知识,为高考常见题型,中等难度,解题的关键是元素推断,答题时注意常见元素化合物知识的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
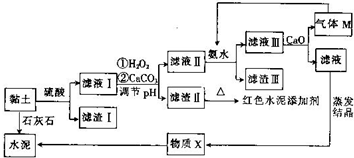
| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
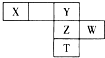 如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )
如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )| A. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| B. | T的最高价氧化物对应的水化物酸性比Z的强 | |
| C. | Y的氢化物沸点高于Z的氢化物,因为H-Y键的键能高于H-Z键 | |
| D. | XY2、XZ2、XW4的化学键类型相同、晶体类型也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
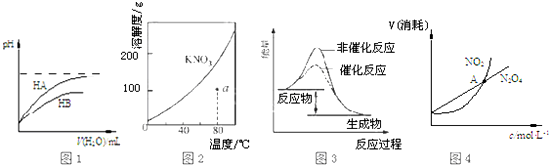
| A. | 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH | |
| B. | 图2表示 KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| C. | 图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图4表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
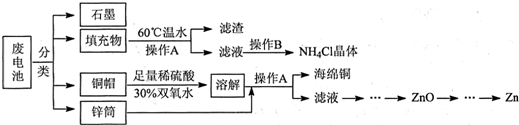
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com