
| A. | Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | CaCO3与醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | Cu与FeCl3溶液反应:Cu+Fe3+═Cu2++Fe2+ |
分析 A.漏写生成水的离子反应;
B.醋酸在离子反应中保留化学式;
C.反应生成碳酸钠和水;
D.电子、电荷不守恒.
解答 解:A.Ba(OH)2溶液与稀硫酸反应的离子反应为2OH-+2H++Ba2++SO42-═2H2O+BaSO4↓,故A错误;
B.CaCO3与醋酸反应的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故B错误;
C.NaHCO3溶液与NaOH溶液反应的离子反应为HCO3-+OH-═CO32-+H2O,故C正确;
D.Cu与FeCl3溶液反应的离子反应为Cu+2Fe3+═Cu2++2Fe2+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHCO3、NaCl、HCl | B. | Na2CO3、NaHCO3、HCl、NaCl | ||
| C. | (NH4)2SO4、NH4Cl、NaNO3、Na2CO3 | D. | NH4Cl、(NH4)2SO4、Na2CO3、NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
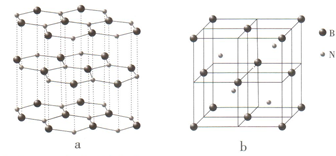 氮元素可形成丰富多彩的物质.
氮元素可形成丰富多彩的物质.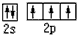 ;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.
;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为2:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆浆中加入CaSO4制豆腐 | |
| B. | 清晨在茂密的森林里看到缕缕阳光穿过林木枝叶 | |
| C. | FeCl3溶液中加入NaOH溶液产生红褐色沉淀 | |
| D. | 使用钢笔时不宜将不同品牌的墨水混用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)合成氨的反应原理为:
(2)合成氨的反应原理为:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol H2、2molN2 | 4mol H2、4molN2 | 2mol NH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| 平衡时N2的体积分数 | w1 | W2 | W3 |
| 混合气体的密度(g•L-1) | ρ1 | ρ2 | ρ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气及其相关产品在生活、生产中应用广泛.
氯气及其相关产品在生活、生产中应用广泛.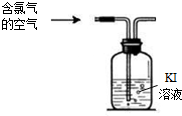
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com