
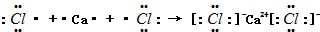 ;
;分析 由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,则n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,则M(XCl2)=$\frac{0.111g}{0.01mol}$=111g/mol,所以XCl2相对分子质量为111,故X的相对原子质量=111-35.5×2=40,即X的质量数为40,X的质子数=质量数-中子数=40-20=20,故X为Ca元素,据此解答.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
则n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,则M(XCl2)=$\frac{0.111g}{0.01mol}$=111g/mol,所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,质子数=质量数-中子数=40-20=20,所以原子序数为20,故答案为:20;
(2)CaCl2属于离子化合物,用电子式表示CaCl2的形成过程为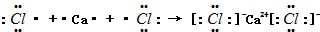 ,
,
故答案为: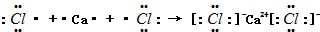 ;
;
(3)Ca水剧烈反应生成Ca(OH)2和H2,溶液呈碱性,故现象为:有气体产生,溶液变红,该反应化学方程式为:Ca+2H2O═Ca(OH)2+H2↑,
故答案为:有气体产生,溶液变红;Ca+2H2O═Ca(OH)2+H2↑.
点评 本题考查离子方程式的计算、结构性质位置关系应用、常用化学用语等,难度不大,注意掌握用电子式表示化学键或物质的形成过程.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应. b.
b.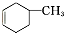 c.
c.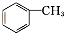
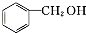 c.
c.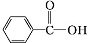
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 等浓度的碳酸钠、碳酸氢钠溶液混合后:c(CO32-)<c(HCO3-) | |
| B. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| C. | 在恒温、恒容条件下,SO2与O2按照物质的量之比为2:1通入达到平衡,若向上述平衡体系中通入氧气,则SO3的百分含量将减小 | |
| D. | pH=3的盐酸和醋酸,等体积混合因为醋酸被稀释pH>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
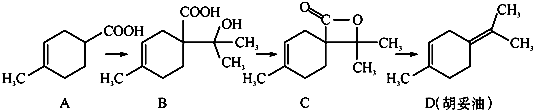
| A. | 从B到C的反应是消去反应 | |
| B. | D分子中所有碳原子一定共面 | |
| C. | 等物质的量的B分别与足量的Na、NaHCO3反应,产生的气体的物质的量前者大于后者 | |
| D. | 若A是由2-甲基-1,3-丁二烯和丙烯酸(CH2=CHCOOH)加热得到的,则该反应的类型属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素不能形成的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中只有共价键,一定没有离子键 | |
| B. | 金属和非金属一定形成离子化合物 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 离子化合物中可能含有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y同主族 | B. | X原子的半径大于Y原子的半径 | ||
| C. | X的非金属性强于Y的非金属性 | D. | X-的还原性弱于Y-的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体:豆浆、墨水、血液、生理盐水 | |
| B. | 单质:冰、液氯、臭氧、红磷 | |
| C. | 混合物:矿泉水、84消毒液、铝热剂、四氧化三铁 | |
| D. | 常见的氧化剂:高锰酸钾、氯气、硝酸、氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com