
| A. | 己烯、苯、苯酚 | B. | 乙醛、乙酸、乙醇 | C. | 乙酸、乙醇、苯酚 | D. | 乙烷、乙烯、乙炔 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | |
| T |
| A. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| B. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| C. | 五种元素中,只有T是金属元素 | |
| D. | Mg在一定条件下可以和YX2发生反应生成Y单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 双酚A属于酚类 | B. | 双酚A属于芳香族化合物 | ||
| C. | 双酚A与苯酚互为同系物 | D. | 双酚A不属于醇类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
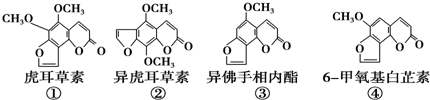
| A. | ②、③互为同系物 | |
| B. | ①、③各1mol与足量氢氧化钠溶液反应时均消耗3molNaOH | |
| C. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 | |
| D. | ③、④互为同分异构体,它们各1mol均能与5molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

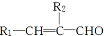 +H2O
+H2O $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +HCl
+HCl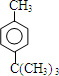 ;
;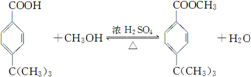 ;
;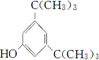 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 10.80 | 30.70 |
| 第二次 | 25.00 | 14.20 | 34.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com