
| A. | 日常生中无水乙醇常用于杀菌消毒 | |
| B. | 目前加碘盐中主要添加的是KI | |
| C. | 绿色食品是不含任何化学物质的食品 | |
| D. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
分析 A.体积分数为75%的酒精溶液常用于灭菌消毒,此浓度杀菌力最强;
B.KIO3较为稳定;
C.任何物质都由化学物质组成;
D.氮的氧化物可导致酸雨及光化学烟雾发生.
解答 解:A.在75%的酒精作用下,乙醇能渗入细胞内,使蛋白质凝固变性,从而起到杀菌的作用,低于这个浓度,其渗透脱水作用减弱,杀菌力不强;而高于此浓度,则会使细菌表面蛋白质迅速脱水,凝固成膜,妨碍乙醇透入,削弱杀菌能力,对病毒无效,故A错误;
B.KIO3较为稳定,为加碘食盐中添加剂,故B错误;
C.绿色食品是指在无污染的条件下种植、养殖、施有机肥料、不用高毒性、高残留农药、在标准环境、生产技术、卫生标准下加工生产、经权威机构认定并使用专门标志的安全、优质、营养类食品的统称,任何物质都由化学物质组成,故C错误;
D.氮的氧化物可导致酸雨及光化学烟雾发生,则“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关,故D正确.
故选D.
点评 本题考查较为综合,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意常见物质的性质,牢固把握相关基础知识是解答的关键,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 阿伏伽德罗常数就是6.02×1023 mol-1 | |
| B. | 摩尔质量就是1 mol物质的质量 | |
| C. | 物质的量是衡量物质所含一定数目微观粒子集合体的物理量 | |
| D. | 物质的量的单位--摩尔只适用于微观粒子分子、原子和离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面是硫及其化合物的分类图,请回答下列问题:
下面是硫及其化合物的分类图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Mg2+、AlO2-、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
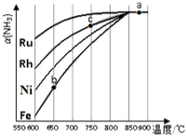 氨气在生产、生活和科研中应用十分广泛.
氨气在生产、生活和科研中应用十分广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 | |
| B. | 化学反应速率为0.8 mol•L-1•s-1是指1秒钟时某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 化学反应的速率可以是g•(L•s)-1,也可以是kg•(L•s)-1,甚至可以用t•(L•s)-1表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
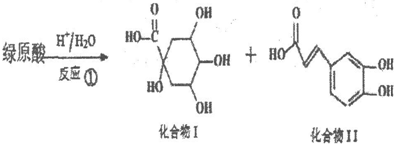
 .
.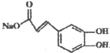 ),则试剂X是NaHCO3溶液.
),则试剂X是NaHCO3溶液.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com