
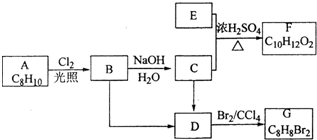
 A��G�����л���������ǵ�ת����ϵ��ͼ��
A��G�����л���������ǵ�ת����ϵ��ͼ��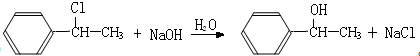 ��
�� ����ṹ��ʽ����
����ṹ��ʽ���� ���� E������������������ܶ�Ϊ30����Mr��E��=30��2=60��6.0gE�����ʵ�����0.1mol����ȫȼ�պ�����CO2�� H2O�����ʵ����ֱ�Ϊ$\frac{8.8g}{44g/mol}$=0.2mol��$\frac{3.6g}{18g/mol}$=0.2mol��������N��C��=$\frac{0.2mol}{0.1mol}$=2��N��H��=$\frac{0.2mol��2}{0.1mol}$=4����N��O��=$\frac{60-12��2-4}{16}$=2����E�ķ���ʽ��C2H4O2��
AΪһȡ���������ɷ���ʽ��֪Ϊ����ͬϵ���AΪ ��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ
��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ ��B����ˮ�ⷴӦ����CΪ
��B����ˮ�ⷴӦ����CΪ ��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ
��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ ��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ
��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ ����GΪ
����GΪ ���ݴ˽��н��
���ݴ˽��н��
��� �⣺E������������������ܶ�Ϊ30����Mr��E��=30��2=60��6.0gE�����ʵ�����0.1mol����ȫȼ�պ�����CO2�� H2O�����ʵ����ֱ�Ϊ$\frac{8.8g}{44g/mol}$=0.2mol��$\frac{3.6g}{18g/mol}$=0.2mol��������N��C��=$\frac{0.2mol}{0.1mol}$=2��N��H��=$\frac{0.2mol��2}{0.1mol}$=4����N��O��=$\frac{60-12��2-4}{16}$=2����E�ķ���ʽ��C2H4O2��
AΪһȡ���������ɷ���ʽ��֪Ϊ����ͬϵ���AΪ ��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ
��A�������ڹ��������·���ȡ����Ӧ����B����B�к���һ��������BΪ ��B����ˮ�ⷴӦ����CΪ
��B����ˮ�ⷴӦ����CΪ ��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ
��C��E����������Ӧ����F�����F�ķ���ʽ��֪��Ӧ�Ƿ���������Ӧ����EΪCH3COOH��FΪ ��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ
��B��Cת�����õ�D��D���巢���ӳɷ�Ӧ����G����B��C��������ȥ��Ӧ����D����DΪ ����GΪ
����GΪ ��
��
��1��������������֪��E�ķ���ʽΪC2H4O2��
�ʴ�Ϊ��C2H4O2��
��2����BΪ ��B����ˮ�ⷴӦ����C
��B����ˮ�ⷴӦ����C ������B����C�Ļ�ѧ����ʽΪ��
������B����C�Ļ�ѧ����ʽΪ��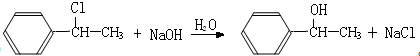 ��
��
�ʴ�Ϊ��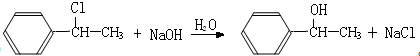 ��
��
��3����B����D�� ������ȥ��Ӧ����
������ȥ��Ӧ���� ����Ӧ����Ϊ���������ƴ���Һ�����ȣ�
����Ӧ����Ϊ���������ƴ���Һ�����ȣ�
�ʴ�Ϊ��NaOH�Ĵ���Һ�����ȣ�
��4����A����B����ȡ����Ӧ����D����G���ڼӳɷ�Ӧ��
�ʴ�Ϊ��ȡ����Ӧ���ӳɷ�Ӧ��
��5����G�� ����ͬ���칹���У�������һ�����IJ���ֻ��һ�֣��Գ��Ըߣ����Ժ���2����ͬ��ȡ�������Ҵ��ڶ�λ��Ϊ
����ͬ���칹���У�������һ�����IJ���ֻ��һ�֣��Գ��Ըߣ����Ժ���2����ͬ��ȡ�������Ҵ��ڶ�λ��Ϊ ��������3��ȡ����ʱ��ȡ������������ͬ��������ȡ��������2�֣��ʲ����ܺ���3��ȡ���������Կ���4��ȡ������Ϊ2��-Br��2��-CH3���ֱ�Ϊ
��������3��ȡ����ʱ��ȡ������������ͬ��������ȡ��������2�֣��ʲ����ܺ���3��ȡ���������Կ���4��ȡ������Ϊ2��-Br��2��-CH3���ֱ�Ϊ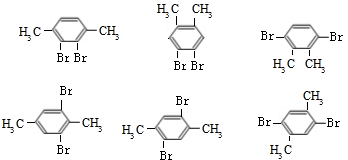 ���ʷ���������ͬ���칹�干��7�֣�
���ʷ���������ͬ���칹�干��7�֣�
���к˴Ź�������������壬�ҷ������Ϊl��1���ǣ� ��
��
�ʴ�Ϊ��7�� ��
��
���� ���⿼���л����ƶϣ���Ŀ�Ѷ��еȣ��ؼ���ȷ��AΪ�ұ����ٽ��ת����ϵ������ʽ�ƶϣ���5����ͬ���칹����дΪ�״��㡢�ѵ㣬ע���������ճ����л���ṹ�����ʣ�����������ѧ���ķ���������������������������


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������̼̼˫�� | |
| B�� | ������������̼̼���� | |
| C�� | �����ķ��ӽṹ���������� | |
| D�� | ��������������ԭ�ӿ���ͬһƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ��ʢˮ��ϴ��ƿ | B�� | ͨ��װ�й�����ˮ��ϴ��ƿ | ||
| C�� | ����H2��� | D�� | ͨ������KMnO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڢ� | B�� | �ޢ� | C�� | �ݢޢ� | D�� | �ڢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ӳ�����X��Y��Z | B�� | ��̬�⻯���ȶ��ԣ�XH3��YH3��ZH3 | ||
| C�� | ԭ��������X��Y��Z | D�� | Ԫ�صķǽ�����ǿ����X��Y��Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������� | B�� | D2��H2 | C�� | 40K��39K | D�� | 40K��40Ca |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����A��B��̼�Ǽ���ͬ����C�Ľṹ�����
����A��B��̼�Ǽ���ͬ����C�Ľṹ�����| A�� | 4�� | B�� | 5�� | C�� | 6�� | D�� | 8�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Al��OH��3��Fe��OH��3�������� | |
| B�� | ���û��Һ�У�$\frac{c��A{l}^{3+}��}{c��F{e}^{3+}��}$=3.25��104 | |
| C�� | ���û��Һ���������Ũ�ȴ�С��c��Cu2+��=c��Al3+����c��Fe3+����c��H+�� | |
| D�� | ����ԭ��Һ����μ���NaOH��Һ�������������Cu��OH��2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
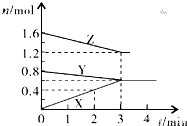 ij�¶�ʱ����2L�ܱ������У�X��Y��Z�������ʵ����ʵ������仯��������ͼ��ʾ����ͼ�����ݷ���
ij�¶�ʱ����2L�ܱ������У�X��Y��Z�������ʵ����ʵ������仯��������ͼ��ʾ����ͼ�����ݷ����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com