
(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化
B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL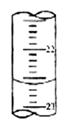
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
(1)红色、无色 (2)B (3)待测液润洗锥形瓶 偏高
(4)酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗2-3次
(5)22.60 (6)0.0800
解析试题分析::(1)标准酸滴定NaOH溶液,以酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶锥形瓶内溶液颜色的变化。
(3)装液前不能润洗;若锥形瓶用待测液润洗,待测液的物质的量偏多,造成V(酸)增大,根据c(碱)=c(酸)×V(酸)/V(碱)可知,c(碱)偏高;
(4)酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗2-3次;
(5)滴定管中的液面的读数为22.60mL,故答案为:22.60;
(4)两次消耗的盐酸标准液的体积为24.90mL,25.10mL,均有效,盐酸溶液的平均体积为(24.90mL+25.10mL)/2=25.00mL,
HCl~NaOH
1 1
0.1000mol?L-1×25.00 c(烧碱)×20.00
解得c(盐酸)=0.1250mol/L,
考点:中和滴定。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.同主族元素的单质从上到下,熔点升高 |
| B.元素的最高正化合价在数值上等于它所在的族序数 |
| C.同周期主族元素的原子半径越小,越难失去电子 |
| D.元素的非金属性越强,它的气态氢化物水溶液的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在某温度时,测得纯水中的c(H+)=2.0×10-7 mol·L-1,则c(OH-)为
| A.2.0×10-7 mol·L-1 |
| B.0.1×10-7 mol·L-1 |
| C.1.0×10-14/2.0×10-7 mol·L-1 |
| D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(6分)某学生用0.100 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,
其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
10分)使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸。
Ⅰ.实验步骤:
(1)滴定前的准备
①滴定管:___________________→洗涤→润洗→装液→赶气泡→调液面→记录。记录盛装 0.1000 mol/L NaOH溶液的碱式滴定管的初始读数时,液面位置如图所示,则此时的读数为_____________mL。
②锥形瓶:用酸式滴定管量取待测稀盐酸20.00mL于锥形瓶中,向其中滴加2滴酚酞溶液作指示剂。
(2)滴定
用标准的NaOH溶液滴定待测的稀盐酸时,左手操作滴定管活塞,右手旋摇锥形瓶,眼睛注视 。滴定至终点时,记录NaOH溶液的终点读数。再重复滴定3次。
Ⅱ.实验记录:
 滴定次数 滴定次数实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com