
| A. | 将Fe(OH)3和水充分搅拌,滴加酚酞试液溶液变红色 | |
| B. | 在FeCl3溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | 在酸性FeSO4溶液中滴加KMnO4 溶液至反应完全,溶液呈无色 | |
| D. | 在FeCl3溶液中加入铜粉能溶解 |
分析 A、Fe(OH)3难溶于水;
B、Fe3+和SCN-生成的不是沉淀;
C、Fe2+能被高锰酸钾溶液氧化为Fe3+;
D、Fe3+能和铜粉反应.
解答 解:A、Fe(OH)3难溶于水,故其水溶液的碱性极弱,而酚酞在pH>8时才会显浅红色,故向Fe(OH)3的水溶液中滴入酚酞,溶液几乎不变色,故A错误;
B、Fe3+和SCN-反应生成血红色溶液,不是沉淀,故B错误;
C、Fe2+能被高锰酸钾溶液氧化为Fe3+,故完全反应后溶液成棕黄色,故C错误;
D、Fe3+能和铜粉反应生成Fe2+和Cu2+,使铜粉溶解,故D正确.
故选D.
点评 本题考查了常见反应的现象和氢氧化铁的水溶性等问题,应注意的是Fe3+和SCN-反应生成的不是沉淀,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Na2O2使酚酞溶液变红 | Na2O2能漂白织物、纸浆 |
| B | SO2可使石蕊溶液先变红后褪色 | SO2的水溶液具有酸性和漂白性 |
| C | NH3、HCl可用作喷泉实验 | NH3、HCl都极易溶于水 |
| D | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol/L | B. | 0.017 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 紫色高锰酸钾溶液中溶入SO2后,溶液颜色褪去,说明SO2具有漂白性 | |
| B. | 向某溶液中滴加盐酸酸化的氯化钡溶液产生白色沉淀,说明此溶液中一定含有SO32- | |
| C. | 铜和铁的合金与1L 1mol/L的硝酸恰好反应,生成Fe2+,则未被还原的硝酸的物质的量为0.75mol | |
| D. | 氯气与铁反应生成氯化铁,所以不能用钢瓶盛放液氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
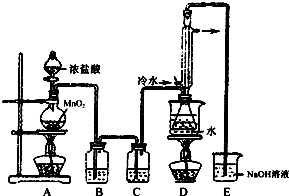 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲表示2molH2(g)所具有的能量一定比2mol气态水所具有的能量多483.6KJ | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将t1℃时的A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的HA溶液的pH小于HB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
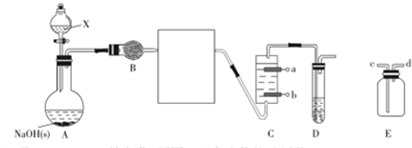
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com