
| A. | HI和NaI | B. | H2S和CO2 | C. | Cl2和CCl4 | D. | Na2O2和NaOH |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,以此解答该题.
解答 解:A.HI含有共价键,NaI含有离子键,化学键类型不同,故A错误;
B.H2S和CO2都只含有极性共价键,故B正确;
C.Cl2含有非极性键,CCl4含有极性键,化学键不同,故C错误;
D.Na2O2含有离子键和非极性共价键,NaOH含有离子键和极性键,故D错误.
故选B.
点评 本题考查了离子键和共价键的判断,根据物质构成微粒及微粒间作用力分析解答即可,不能根据是否含有金属元素判断离子键,并不是所有物质都含有化学键,稀有气体不含化学键,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SiO3>H2CO3>H3PO4 | B. | 稳定性:PH3<H2S<HCl<HF | ||
| C. | 非金属性:Cl>S>P>Si | D. | 离子半径:Cl->F->Na+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | 2Na2O2+2CO2=2Na2CO3+O2 | ||
| C. | 2NaOH+Cl2=NaCl+NaClO+H2O | D. | NH3+CO2+H2O=NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 第IA族元素与第VIIA族可能形成离子化合物,也可能形成共价化合物 | |
| D. | 非金属元素间不可能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
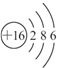 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 还原性:HF<HCl<HBr<HI | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 氧化性:F2<Cl2<Br2<I2 | D. | 沸点:Cl2<F2<Br2<I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com