
| A. | 它们的化学性质完全不同 | B. | 它们是碳元素的三种同位素 | ||
| C. | 它们是碳元素的三种单质 | D. | 它们是碳元素的同素异形体 |
分析 A.612C、613C、614C为碳元素的三种同位素,是碳元素的不同核素,化学性质相似;
B.具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;
C.元素符号左上角数字为质量数,左下角数字为质子数,中子数=质量数-质子数,612C、613C、614C为中子数不同的碳原子;
D.同素异形体是同种元素形成的不同单质.
解答 解:元素符号左上角数字为质量数,左下角数字为质子数,中子数=质量数-质子数,612C、613C、614C中子数分别为6、7、8,
A.612C、613C、614C核外电子排布相同,中子数不同,化学性质相似,故A错误;
B.612C、613C、614C中子数不同碳原子,为碳元素的三种同位素,故B正确;
C.612C、613C、614C中子数不同碳原子,不是碳元素的三种单质,故C错误;
D.612C、613C、614C中子数不同碳原子,是碳元素的不同核素,同素异形体必须是单质,故D错误;
故选B.
点评 本题考查同位素、核素以及同位素性质,比较基础,旨在考查学生对基础知识的掌握,注意化学“五同”的辨析,题目难度不大.


科目:高中化学 来源: 题型:解答题
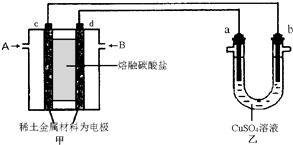
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
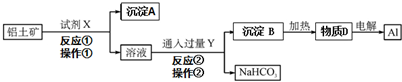
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
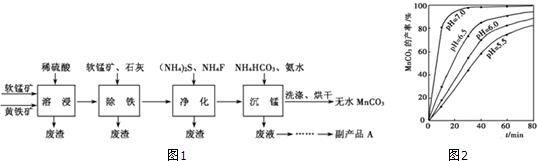
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  除去CO的CO2 | B. |  萃取时振荡混合液 | ||
| C. | 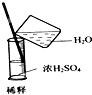 稀释浓硫酸 | D. |  向试管中滴加液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时OH-向正极移动 | B. | 放电时正极上有氢气生成 | ||
| C. | 水既是氧化剂又是溶剂 | D. | 总反应为:2Li+2H2O═2LiOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
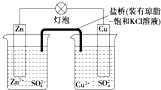
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 盐桥中的K+移向ZnSO4溶液 | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 电池反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
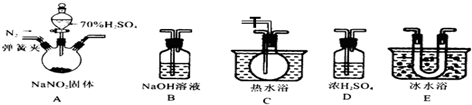
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com