
设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气和足量镁粉充分反应,转移的电子数为2NA
科目:高中化学 来源:2015-2016学年广西省高二上段考文化学试卷(解析版) 题型:选择题
下列反应属于吸热反应的是
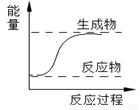
A.CaO+H2O=Ca(OH)2
B.2Na+O2  Na2O2
Na2O2
C.Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
D.右图所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:选择题
质量为a g的铜丝,在空气中灼热一段时间后,趁热放入下列物质中,充分反应后铜丝质量仍为ag的是
A.盐酸 B.CO2 C.HNO3 D.乙醇
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测二化学试卷(解析版) 题型:选择题
化学与社会、生产密切相关,下列说法正确的是:
A、高纯度的单晶硅用于制造光导纤维
B、从海水中提取物质都必须通过化学反应才能实现
C、乙酸乙酯在碱性条件下水解称为皂化反应
D、可溶性铜盐有毒,在生命体中铜是一种不可缺少的微量元素
查看答案和解析>>
科目:高中化学 来源:2016届河北省衡水市高三上一轮复习检测一化学试卷(解析版) 题型:选择题
己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O则RO4n-中R的化合价是( )
A.+3 B +4 C.+5 D.+6
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上12月月考化学试卷(解析版) 题型:选择题
下列实验可实现鉴别目的是( )
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2016届西藏日喀则高级中学高三上期末理综化学试卷(解析版) 题型:填空题
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量不减少,请回答下列问题:
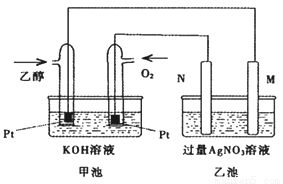
(1)M电极的组成元素在周期表中的位置是_________________,电极名称是__________,加入乙醇的铂电极的电极反应式为________________,写出乙池中发生的化学反应的离子式________________;
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为____________L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为________;
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为________________;
(4)甲烷也是一种很好的清洁能源.蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol.356g“可燃冰”(若分子式为CH4•9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为__________kJ;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上期末考试化学试卷(解析版) 题型:选择题
下列反应不属于氧化还原反应的是( )
A.2Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
B.3NO2+H2O=2HNO3+NO
C.Ca(OH)2+SO2=CaSO3+H2O
D.Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第二次质检化学试卷(解析版) 题型:实验题
铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.7500g试样中加入100.00 mL 0.1200mol/mol KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250 mL容量瓶中,定容。取25.00 mL溶液,用0.1000mol/molFeSO4溶液滴定至终点,消耗16.00 mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000mol/molNa2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2 2I-+S4O62-),消耗14.00 mL。
2I-+S4O62-),消耗14.00 mL。
已知:酸性条件下,MnO4-的还原产物为Mn2+。
(1)若步骤3加入氨水产生沉淀时,溶液的pH=2.0,则溶液中c(Fe3+)=___________。
(已知室温下Ksp[Fe(OH)3]=2.6×10-39)
(2)步骤3若未除去Fe3+,则测得的Cu2+的物质的量将___________(填“偏高”“偏低”或“不变”)。
(3)计算试样中Cu2S和CuS的质量分数(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com