
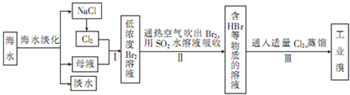
| ||
| ||
| ||


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
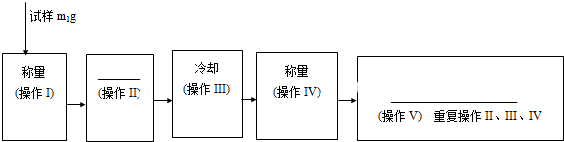

查看答案和解析>>
科目:高中化学 来源: 题型:
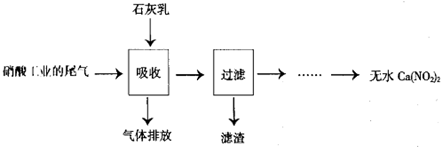
查看答案和解析>>
科目:高中化学 来源: 题型:
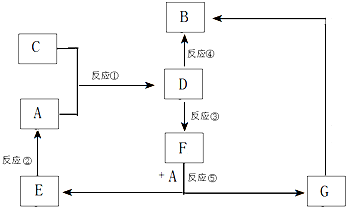 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:
A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素.已知:| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 | (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | (用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、②③⑥ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
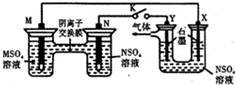 在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )| A、左装置中溶液c(M2+)减小 |
| B、N和X的电极反应式均为:N2++2e-=N |
| C、Y电极上有O2产生,发生还原反应 |
| D、若M电极转移了0.4mol电子,则y电极生成2.24L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Na+、Br- |
| B、NH4+、Na+、AlO2- |
| C、Ba2+、Al3+、Cl- |
| D、K+、Mn4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精在实验台上燃烧时,用水扑灭火焰 |
| B、给试管中的液体加热时,试管口不能对着别人 |
| C、大量有毒易燃气体在室内扩散,应立即打开排气扇开关 |
| D、不慎将浓硫酸沾到皮肤上,应用较多的水冲洗,然后涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
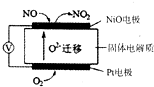 NO2是汽车尾气中的主要污染物之一.
NO2是汽车尾气中的主要污染物之一.
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com