

分析 由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,以此检验;
(2)pH=12的Na2CO3溶液,n(Na)=2n(C),c(OH-)=0.01mol/L,溶液显碱性,结合电荷守恒、物料守恒等分析选项;
(3)Fe2+、Cu2+等杂质,均可与碳酸钠反应;适量KMnO4将Fe2+转化为Fe(OH)3,由电子守恒计算.
解答 解:由实验流程可知,含锌物料为原料,采用硫酸浸出锌,过滤除杂,得到滤液中含锌离子,与加入的Na2CO3溶液反应生成碱式碳酸锌,最后焙解获得活性氧化锌.
(1)Na的焰色为黄色,则检验溶液中含有Na+,常用焰色反应,故答案为:焰色反应;
(2)pH=12的Na2CO3溶液,由化学式可知,n(Na)=2n(C),
A.该溶液中存在电荷守恒为:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A错误;
B.该溶液中存在电荷守恒,c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),碳酸钠溶液中CO32-水解溶液显碱性,c(CO32-)>c(HCO3-),则c(Na+)+c(H+)>c(CO32-)+2c(HCO3-)+c(OH-)正确,故B正确;
C.该溶液中存在物料守恒n(Na)=2n(C):c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故C正确;
D.若将该溶液稀释至100倍,水解平衡正向进行,氢氧根离子浓度减小小于100倍,则pH>10,故D错误;
故答案为:BC;
(3)溶解后得到酸性溶液,要调节溶液的pH至5.4,需要升高pH,故应加入Na2CO3,Fe2+的浓度为0.009mol•L-1,则
n(Fe2+)=0.009 mol/L×0.5L=0.0045mol,由电子得失守恒,则n(KMnO4)=$\frac{0.0045mol}{7-4}$=0.0015 mol,故答案为:Na2CO3;0.0015.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、对操作步骤的分析评价、物质的分离提纯、氧化还原反应计算等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 若增大压强,则混合气体的平均分子量减小 | |
| B. | 将容器体积变为0.5 L,Z的平衡浓度变为原来的2倍 | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 保持体积不变,向其中充入1 mol He气体,平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2→O2的变化过程中,必须要加入合适的氧化剂才能实现 | |
| B. | Al2O3+3C+N2═2AlN+3CO中,Al2O3是氧化剂 | |
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中MnO2是还原剂 | |
| D. | 有金属单质参加的反应中,金属单质一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
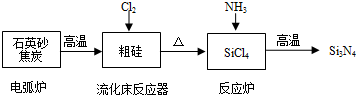
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族金属的原子半径越大,熔点越高 | |
| B. | 分子间作用力越强,分子晶体的熔点越高 | |
| C. | 稀有气体原子序数越大,熔点越低 | |
| D. | 同周期元素的原子半径越小,越易失去电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com