
| A. | 0.5 mol | B. | 5 mol | C. | 196g | D. | 98g |
分析 已知铅蓄电池放电转移的电子能氧化Cl-制得Cl2 22.4L,即生成氯气为1mol,串联电路中转移电子守恒,根据氯气和硫酸之间的关系式计算.
解答 解:电解氯化钠溶液时阳极上氯离子放电生成氯气,制得1mol氯气转移电子的物质的量为1mol×[0-(-1)]×2=2mol,
设消耗硫酸的物质的量为ymol,
放电时,铅蓄电池的电池反应式为:
PbO2+Pb+2H2SO4=2PbSO4+2H2O 转移电子
2mol 2mol
y 2mol
则y=2mol,所以消耗硫酸2mol,质量为2mol×98g/mol=196g,
故选C.
点评 本题以电解池为载体考查了氧化还原反应的有关计算,明确原电池和电解池中发生的反应以及反应过程中电荷守恒是解本题的关键,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
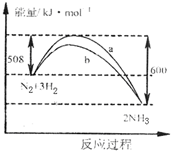
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 mol N2和3 mol H2充分反应后,放出92 kJ热量 | |
| C. | 加入催化剂可增大正反应速度,降低逆反应速率 | |
| D. | b曲线是加入催化剂时的能量变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制单质氯:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑ | |
| B. | 制单质镁:2Na+MgCl2$\frac{\underline{\;高温\;}}{\;}$2NaCl+Mg | |
| C. | 制聚氯乙烯:n CH2=CHCl $\stackrel{催化剂}{→}$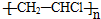 | |
| D. | 制纯碱:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
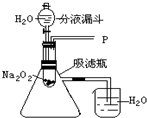 水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:
水能灭火也可以引火.把少量过氧化钠(Na2O2)粉末用干燥脱脂棉包裹(脱脂棉和过氧化钠不反应),将少量水滴到包有过氧化钠的脱脂棉上,则脱脂棉迅速发生燃烧.小明对此现象很感兴趣,于是他和同学们进行如下探究:| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
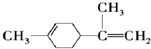
| A. | 柠檬烯的一氯代物有8种 | |
| B. | 柠檬烯和  互为同分异构体 互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化、加聚、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋和石灰水验证鸡蛋壳中含有碳酸钙 | |
| B. | 将淀粉在唾液淀粉酶的作用下水解 | |
| C. | 用米汤检验食盐中是否加了碘 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com