
【题目】

请回答下列问题:
(1)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸 mL。
(2)接下来完成此实验你将用到的仪器有20 mL量筒、烧杯、玻璃棒、____________。
(3)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(4)下列操作会使所配溶液浓度偏低的是 。
A.用量筒量取浓硫酸,读数时仰视刻度线 |
B.转移溶液时未洗涤烧杯 |
C.容量瓶用蒸馏水洗净后仍残留有蒸馏水 |
D.定容时俯视容量瓶的刻度线 |
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线
【答案】(1)13.6;(2)500 mL容量瓶、胶头滴管;(3)0.50 mol/L H2SO4(aq);0.25 mol/L;(4)BE
【解析】试题(1)配制480 mL 0.50 mol/L的稀硫酸,实验室没有480mL的容量瓶,应该选用500mL的,稀释前后溶质的物质的量不变,v×![]() =500×10-3×0.5,v=13.6×10-3L,需要该浓硫酸13.6mL;(2)配制该物质的量浓度需要的仪器有500mL的容量瓶、胶头滴管、20 mL量筒、烧杯、玻璃棒;(3)标签上应写明硫酸的浓度,即0.50mol·L-1H2SO4(aq);稀释前后溶质的物质的量不变,10×10-3×0.5=20×10-3×c,c=0.25mol·L-1;(4)A、用量筒量取浓硫酸,读数时仰视,量取的液体体积增大,溶质的物质的量增加,所配溶液浓度增加,不符合题意;B、转移时,未洗涤烧杯,溶质的物质的量减少,所配溶液的浓度降低,符合题意;C、容量瓶残留蒸馏水,对本实验无影响,不符合题意;D、定容时俯视容量瓶,所配溶液的体积减少,物质的量浓度增加,不符合题意;E、定容时摇匀后,发现液面低于刻度线,再加水至刻度线,对原溶液稀释,物质的量浓度偏低,符合题意;B、E是符合题意的。
=500×10-3×0.5,v=13.6×10-3L,需要该浓硫酸13.6mL;(2)配制该物质的量浓度需要的仪器有500mL的容量瓶、胶头滴管、20 mL量筒、烧杯、玻璃棒;(3)标签上应写明硫酸的浓度,即0.50mol·L-1H2SO4(aq);稀释前后溶质的物质的量不变,10×10-3×0.5=20×10-3×c,c=0.25mol·L-1;(4)A、用量筒量取浓硫酸,读数时仰视,量取的液体体积增大,溶质的物质的量增加,所配溶液浓度增加,不符合题意;B、转移时,未洗涤烧杯,溶质的物质的量减少,所配溶液的浓度降低,符合题意;C、容量瓶残留蒸馏水,对本实验无影响,不符合题意;D、定容时俯视容量瓶,所配溶液的体积减少,物质的量浓度增加,不符合题意;E、定容时摇匀后,发现液面低于刻度线,再加水至刻度线,对原溶液稀释,物质的量浓度偏低,符合题意;B、E是符合题意的。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明: ![]() 不稳定,不考虑)
不稳定,不考虑)
请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知, ![]() ,则
,则![]() 和
和![]() 等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
(5)常温下, ![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() 的电离平衡常数Ka_______________。
的电离平衡常数Ka_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。
(2)硒、砷、溴三种元素的第一电离能从大到小的顺序为___________(用元素符号表示)。
(3)两种三角锥形气态氢化物PH3和NH3的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_____________________________________________________________。
(4)常温下PCl5是白色晶体,在148℃时熔化成能导电的熔体。该熔体由A、B两种微粒构成,A、B分别与CCl4、SF6互为等电子体,则A的化学式为__________________,其中心原子杂化方式为_______________。
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为ρg·cm-3),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。


①与Au距离最近的Cu个数为________。
②该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为__________,则晶胞中Cu原子与Au原子中心的最短距离d=________cm。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为__________(![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态N2O4是火箭推进系统的有效氧化剂。实验室制备少量N2O4的流程如下:
![]()
下列分析正确的是
A. 反应①、③中氮元素的化合价发生了变化
B. 反应②利用了NH3的氧化性
C. 反应④的颜色变化是由化学平衡移动引起的
D. 反应①可由图所示装置实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
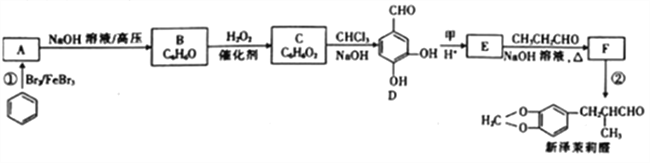
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
已知:①RCHO+R'CH2CHO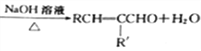
②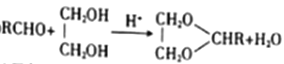
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备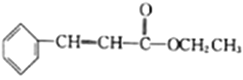 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或实验操作不正确的是
A. 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中
B. 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出
C. NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热
D. 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. ①与③溶液中,水的电离程度:①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
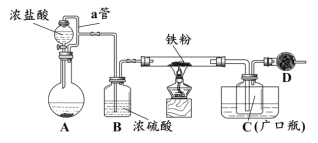
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com