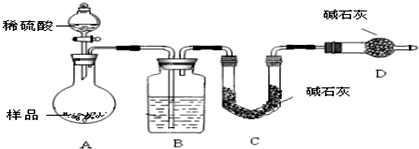
分析:由装置图可知,实验原理为:混合物中加入硫酸,转化为二氧化硫、二氧化碳,除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,进而计算各组分的质量分数.
(1)由于需要测定二氧化碳的质量,整套装置应气密性良好,故实验之前应检验装置的气密性;
(2)实验测定二氧化碳的质量,进而计算碳酸钠的质量,要计算质量分数,需要知道样品的总质量,故应需要用托盘天平称量样品的质量;利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳加入E装置中,影响测量结果;
(3)实验测定Na
2CO
3与Na
2SO
3混合物中各组分的含量,样品和酸反应生成的气体为二氧化碳和二氧化硫气体,利用B装置除去二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,为避免二氧化硫气体对测定结果的干扰,装置C作用是用品红试液验证二氧化硫是否被除净;
(4)实验原理是除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,所以进入装置E中的二氧化碳要干燥、不含二氧化硫,装置B的作用是除去气体中的二氧化硫,试剂全部吸收二氧化硫,不能吸收二氧化碳且不能生成二氧化碳;装置C的作用是验证二氧化硫是否除尽,装置D的作用是干燥气体;
(5)装置内会残留部分二氧化碳,应使二氧化碳全部被装置E中药品吸收,故通入大量的空气目的是排尽装置内的二氧化碳,使生成的二氧化碳能够全部进入装置E中药品吸收;由于空气中含有二氧化碳,应先除去空气中的二氧化碳,若不除去空气中的二氧化碳,导致测定二氧化碳的质量增大,计算所得碳酸钠的质量增大,引起测定的Na
2S0
3质量减小;
(6)装置E在实验完成时增重4.4g为二氧化碳的质量,物质的量为
=0.1mol,根据碳元素守恒可知混合物中碳酸钠的质量为0.1mol×106g/mol=10.6g,所以亚硫酸钠的质量为23.2g-10.6g=12.6g,亚硫酸钠物质的量为
=0.1mol,据此计算.
解答:
解:分析可知实验原理为:混合物中加入硫酸,转化为二氧化硫、二氧化碳,除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,进而计算各组分的质量分数.
(1)由于需要测定二氧化碳的质量,整套装置应气密性良好,故实验之前应检验装置的气密性;
故答案为:检验装置的气密性;
(2)实验测定二氧化碳的质量,进而计算碳酸钠的质量,要计算质量分数,需要知道样品的总质量,故应需要用托盘天平称量样品的质量;
利用E装置的增重确定生成的二氧化碳的质量,故F装置目的是防止空气中的水蒸气、二氧化碳加入E装置中,影响测量结果;
故答案为:托盘天平;防止空气中的水蒸气、二氧化碳加入E装置中;
(3)样品和酸反应生成的气体为二氧化碳和二氧化硫气体,利用B装置除去二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,所以装置C的作用是用品红试液验证二氧化硫是否被B吸收完全;有人提出该溶液可能引起Na
2CO
3含量的测量结果比实际值偏低,是基于二氧化碳能溶于水;
故答案为:检验SO
2是否被B吸收完全;CO
2可溶于水;
(4)实验原理是除去反应生成的二氧化硫,利用E装置的增重确定生成的二氧化碳的质量,根据二氧化碳的质量计算混合物中碳酸钠的质量,故进入装置E中的二氧化碳要干燥、不含二氧化硫,所以装置B的作用是除去气体中的二氧化硫,试剂是吸收二氧化硫,不能吸收二氧化碳且不能生成二氧化碳,分析选项中试剂可知应选择c.酸性高锰酸钾溶液;装置C的作用是验证二氧化硫是否除尽,装置D的作用是干燥气体,选择试剂为a(浓硫酸),E和F装置中是盛碱石灰的干燥管,利用E装置的增重确定生成的二氧化碳的质量,F为了排除空气中的二氧化碳,水蒸气进入装置E产生误差;
故答案为:c;a;g;
(5)装置内会残留部分二氧化碳,应使二氧化碳全部被装置E中药品吸收,所以通入大量的空气目的是排尽装置内的二氧化碳,使生成的二氧化碳能够全部被装置E中药品吸收;由于空气中含有二氧化碳,应先除去空气中的二氧化碳,若不除去空气中的二氧化碳,导致测定二氧化碳的质量增大,计算所得碳酸钠的质量增大,引起测定的Na
2S0
3质量减小,导致Na
2SO
3含量偏低,可以使空气先通过e氢氧化钠溶液,除去含有的二氧化碳;
故答案为:使生成的二氧化碳能够全部装置E中药品吸收;e;偏低;
(6)装置E在实验完成时增重4.4g为二氧化碳的质量,物质的量为
=0.1mol,根据碳元素守恒可知混合物中碳酸钠的质量为0.1mol×106g/mol=10.6g,所以亚硫酸钠的质量为23.2g-10.6g=12.6g,物质的量为
=0.1mol,所以则Na
2CO
3与Na
2SO
3的物质的量之比为0.1mol:0.1mol=1:1,
故答案为:1:1.

 为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g 以如图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

 阅读快车系列答案
阅读快车系列答案


 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出).