
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5 s的平均速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 达到平衡时,B的转化率为80% | |
| C. | 相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆) |
分析 A.反应在前5 s的平均速率v(A)=$\frac{\frac{△n}{V}}{△t}$;
B.根据表中数据知,20s时该反应达到平衡状态,根据方程式知△n(A)=△n(B)=(1.0-0.80)mol=0.20mol,转化率=$\frac{反应的n(B)}{初始n(B)}$×100%;
C.温度相同化学平衡常数相同,根据化学平衡常数相等计算平衡时C的浓度;
D.可逆反应达到平衡状态时正逆反应速率相等.
解答 解:A.反应在前5 s的平均速率v(A)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(1.0-0.85)mol}{2L}}{5s}$=0.015 mol•L-1•s-1,故A错误;
B.根据表中数据知,20s时该反应达到平衡状态,根据方程式知△n(A)=△n(B)=(1.0-0.80)mol=0.20mol,转化率=$\frac{反应的n(B)}{初始n(B)}$×100%=$\frac{0.20mol}{1.0mol}$×100%=80%,故B正确;
C.充入1.0mol A和1.0mol B,平衡时n(A)=n(B)=0.80mol,生成n(C)=△n(A)=0.20mol,则c(A)=c(B)=$\frac{0.80mol}{2L}$=0.40mol/L,c(C)=$\frac{0.20mol}{2L}$=0.10mol/L,化学平衡常数K=$\frac{0.10}{0.40×0.40}$=0.625,
若起始时向容器中充入2.0 mol C,设剩余C的物质的量为xmol,
A(g)+B(g)?C(g)
开始(mol) 0 0 2.0
反应(mol)2.0-x 2.0-x 2.0-x
平衡(mol)2.0-x 2.0-x x
平衡时c(A)=c(B)=$\frac{2.0-x}{2}$mol/L、c(C)=$\frac{x}{2}$mol/L,
温度相同化学平衡常数相同,所以$\frac{\frac{x}{2}}{\frac{2.0-x}{2}×\frac{2.0-x}{2}}$=0.625,
x=1.6,
所以达到平衡时C的浓度=$\frac{1.6mol}{2L}$=0.8mol/L,故C错误;
D.可逆反应达到平衡状态时正逆反应速率相等,所以相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)=v(逆)且不等于0,故D错误;
故选B.
点评 本题考查化学平衡常数有关计算,侧重考查学生分析计算能力,明确化学平衡常数只与温度有关是解本题关键,注意化学平衡计算中三段式的灵活运用,题目难度中等,C选项是解答难点.


科目:高中化学 来源: 题型:解答题
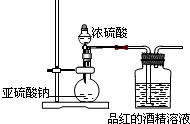
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
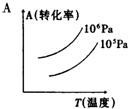 有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )
有一化学平衡mA(g)+nB(g)═PC(g)+qD(g),如图表示的转化率与压强、温度的关系.由此得出的正确结论是( )| A. | 正反应是吸热反应,(m+n)>(p+q) | B. | 正反应是吸热反应,(m+n)<(p+q) | ||
| C. | 正反应是放热反应,(m+n)>(p+q) | D. | 正反应是放热反应,(m+n)<(p+q) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸是一种弱酸是因为次氯酸不稳定,易分解 | |
| B. | 用氯气制漂白粉的主要目的是转变为较稳定,便于贮存的物质 | |
| C. | 漂白粉在空气中容易失效的原因是次氯酸钙易和空气中的水及二氧化碳反应 | |
| D. | 氯原子最外层有7个电子,故在化学反应中易结合一个电子而形成Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;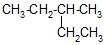 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷; ;
;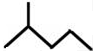 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| C. | 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag | |
| D. | 硫酸溶液与氢氧化铜反应:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com