
分析 (1)硫酸根离子与钡离子反应生成硫酸钡白色沉淀,而且这种白色沉淀不溶于水也不溶于酸,所以一般用可溶性钡盐来检验硫酸根离子的存在;除去硫酸根离子,不能引进新的杂质离子;
(2)碳酸钠在粗盐的提纯过程中有多种作用,除去Ca2+、Mg2+以及加入的过量Ba2+;
(3)操作(2)改为滴加K2CO3溶液,引入杂质钾离子;
(4)根据玻璃棒在各操作中的具体作用进行解答.
解答 解:(1)a.检验溶液中是否存在硫酸根离子的简便方法为:取粗盐溶解于水,静置片刻取上层清液,滴加盐酸后,无明显变化,再滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,溶液中有SO42-,不出现浑浊就说明SO42-已经除尽;b.除去硫酸根离子,可以选用氯化钡溶液,反应生成硫酸钡沉淀和氯化钠,过量的钡离子被后面加入的碳酸钠除去,
故答案为:取粗盐溶解于水,静置片刻取上层清液,滴加盐酸后,无明显变化,再滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,溶液中有SO42-,不出现浑浊就说明SO42-已经除尽;在溶液中加入过量的BaCl2溶液;
(2)碳酸钠溶液可以除去Ca2+以及加入的过量Ba2+,故答案为:除去Ca2+以及加入的过量Ba2+;
(3)操作(2)改为滴加K2CO3溶液,引入了新的杂质钾离子,故答案为:不能,如果滴加K2CO3溶液引入了新的杂质离子;
(4)溶解粗盐时,需要用玻璃棒搅拌,加速粗盐的溶解过程;
过滤时需要用玻璃棒引流,使待滤液体沿玻璃棒流入漏斗,防止外洒;
蒸发时需要用玻璃棒搅拌,防止因局部过热导致液滴或晶体飞溅,
故答案为:搅拌,加速溶解;引流,使待滤液体沿玻璃棒流入漏斗,防止外洒;搅拌,防止因局部过热导致液滴或晶体飞溅.
点评 本题考查了粗盐的提纯、常见离子的检验,题目难度中等,注意掌握粗盐的除杂与提纯方法,明确除杂的方法和原则,除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所进入的过量试剂.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| B. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3放热19.3 kJ,热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知OH-(aq)+H+(aq)═H2O(l)△H=-57.3 kJ/mol 则稀硫酸溶液与稀氢氧化钡溶液反应的反应热△H=2×(-57.3)kJ/mol | |
| D. | 相同条件下,2 mol氢原子所具有的能量大于1 mol氢分子所具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34gH2O2含有的氢原子数为2NA | |
| B. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA | |
| C. | 29g异丁烷中含有共价键数为6.5NA | |
| D. | 4.6g金属钠在空气中加热充分反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl-、Mg2+、H+、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能X可能大于Y | |
| B. | 气态氢化物的稳定性:HmY小于HmX | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | X和Y形成化合物时,X显正价,Y显负价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
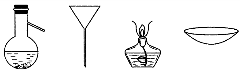
| A. | 蒸发、萃取、蒸馏、过滤 | B. | 蒸馏、过滤、蒸发、蒸发 | ||
| C. | 萃取、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与HNO3 | B. | Cu与FeCl3 | C. | Zn与HCl | D. | FeCl3与NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com