
| ||
| 31.6g |
| 158g/mol |
| 5 |
| 2 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
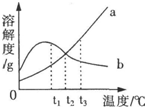 有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )| A、a物质的溶解度随着温度的升高而增大 |
| B、在t2℃时,a、b两种物质的溶液中溶质的质量分数一定相等 |
| C、t3℃时,a物质的溶解度大于b物质的溶解度 |
| D、将a、b两种物质的饱和溶液从t3℃降温至t1℃,a有晶体析出,b无晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若起始时放入3molA和3nmolB,则达平衡时生成3amolC | ||
B、起始时刻和达平衡后容器中的压强比为(1+n):(1+n-
| ||
| C、物质A、B的转化率之比为1:2 | ||
| D、当v正(A)═2v逆(C)时,可断定反应应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 | B、65 |
| C、120 | D、150 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.5g金属锌变成锌离子时失去的电子数目为0.1NA |
| B、常温常压下,2g氢气所含原子数目为2NA |
| C、标准状况下,11.2LH2O含有的分子数为0.5NA |
| D、常温常压下,11.2LCl2含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCH5+离子(碳正离子)所含电子数为10NA |
| B、含0.5molNa2SO4的溶液中含有NA个Na+ |
| C、1molNa2O2固体中含有2NA个O- |
| D、3.2克CH4气体完全燃烧需O2的分子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com