
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】乙烯常用作植物生长调节剂,苯常用作有机溶剂。根据如下转化关系回答:
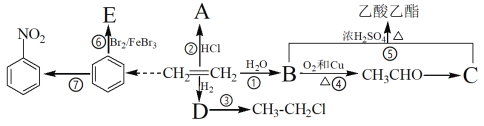
(1)CH2=CH2的电子式:______
(2)③的反应条件:______ E的结构简式:_______
(3)写出下列变化的反应类型:
①__________ ④ __________ ⑥ __________
(4)写出下列过程的化学反应方程式:
②___________________
⑤______________________
⑦________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是( )
A.用Fe、Cu和稀硫酸组成原电池,当负极质量减轻5.6g时,通过溶液的电子为0.2NA
B.标准状况下,2.24L三氯甲烷中含氢原子数为0.1NA
C.密闭容器中,2molSO2和1molO2充分反应后分子总数为2NA
D.11.6g丁烷中所含的非极性键数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
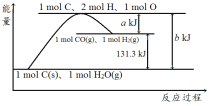
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
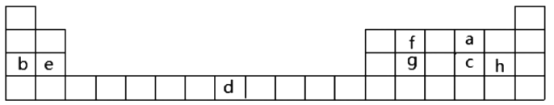
(1)表中字母h元素在周期表中位置___。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型___。
(3)下列事实能说明a元素的非金属性比c元素的非金属性强的有___。
A.a单质与c的氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mola单质比1molc单质得电子数目多
C.a和c两元素的简单氢化物受热分解,前者的分解温度高
(4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式___。
(5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学方程式___。
(6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,该烃分子中碳氢质量比为9∶1,写出烃分子电子式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
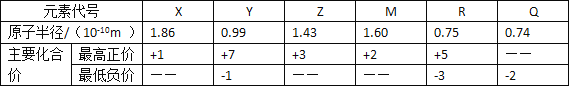
下列说法正确的是( )
A.离子半径:r(R3-)>r(X+)>r(Z3+)
B.元素X 和Q 形成的化合物中不可能含有共价键
C.Q2-比 R3-更容易失去电子
D.Y 的含氧酸酸性一定比 R 的含氧酸的酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖不仅是重要的营养物质,而且还能转化成其他重要的调味品。以淀粉为原料在一定条件下可获得有机物葡萄糖、A、B、C、D,其相互转化关系如图。已知C不能发生银镜反应,D为有浓郁香味,不溶于水的油状液体。
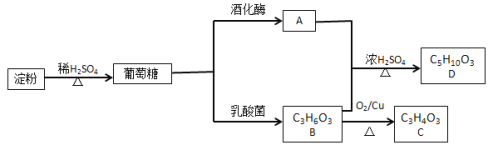
请回答:
(1)与A互为同分异构体的结构式________。
(2) B→C的反应类型是________。
(3) A+ B→D的化学方程式是________________________。
(4) 下列说法正确的是________。
A 有机物A与金属钠反应比水与金属钠反应要剧烈
B 有机物A、B、D可用饱和Na2CO3溶液鉴别
C 两分子B在浓硫酸作用下可以形成六元环状化合物
D 往淀粉水解液中,加入足量的NaOH溶液,再加入碘水,如果溶液未变蓝色,则说明淀粉水解完成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
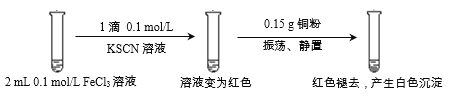
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
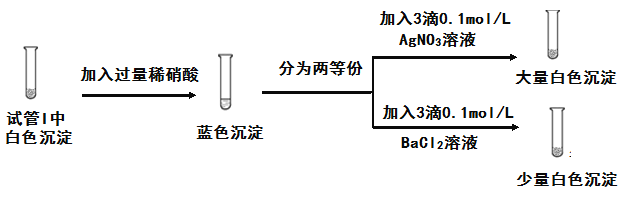
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
I | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 | |
II | 取I中上层清液于试管中,滴加1滴 0.1mol/L KSCN溶液 | 立刻出现红色,同时有白色沉淀生成 |
III | 振荡II中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com