
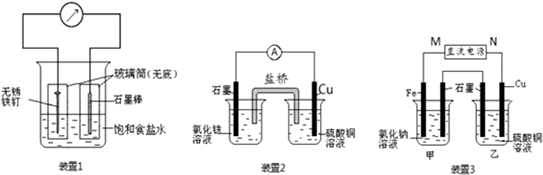
分析 (1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,以此判断并书写电极反应式;
(2)装置2为原电池,负极为Cu,正极为石墨;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,
②根据电极反应和串联电路各极上转移电子的数目相等进行计算.
解答 解:(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-;
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2Fe+2e-═2Fe2+,故答案为:正;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,
发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为$\frac{0.64g}{64g/mol}$=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,
根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V
V=$\frac{22.4L×0.02mol}{2mol}$=0.224L,即224ml,故答案为:224.
点评 本题考查电化学知识,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
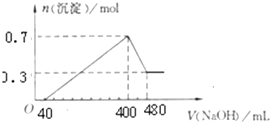 将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:
将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 g H2O所含有的电子数为5NA | |
| B. | 1 mol MgCl2中含有离子数为NA | |
| C. | 1 L 0.1 mol•L-1 Na2SO4溶液中有0.1NA 个Na+ | |
| D. | 1 mol C10H20分子中原子总数为13NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入石膏制得可口的豆腐 | |
| B. | 蒸发饱和食盐水析出氯化钠晶体 | |
| C. | 向沸水中逐滴加入饱和的FeCl3溶液,得到红褐色透明的分散系 | |
| D. | 氢氧化铁溶胶、淀粉溶液、云雾等均具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 按系统命名法,有机物 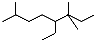 可命名为3,3,7-三甲基-4-乙基辛烷 可命名为3,3,7-三甲基-4-乙基辛烷 | |
| B. | 石油制乙烯、煤的液化、蛋白质的盐析、肥皂去油污均涉及化学变化 | |
| C. | 等质量的乙醇与乙烯完全燃烧,前者生成更多的水 | |
| D. | 全降解塑料 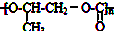 可由环氧丙烷( 可由环氧丙烷(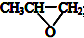 )和CO2反应制得 )和CO2反应制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com