
����Ŀ����ԭ�������ĵ����İ��ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�� 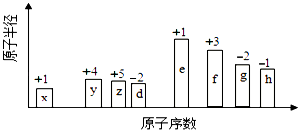
�����жϳ���Ԫ�ػش����⣺
��1��f ��Ԫ�����ڱ���λ������g�����ӽṹʾ��ͼΪ ��
��2����z��d��e��f ����Ԫ���У������Ӱ뾶���ɴ�С������˳��Ϊ���� ��ѧʽ��ʾ����ͬ�����Ƚ�g��h������������Ӧ��ˮ��������Խ�ǿ���ǣ� ��
��3����x��zԪ�����һ����ԭ�ӹ��ۻ����д�������ʽ ��
��4����x��z��h����Ԫ�ع��ɵ��Σ���ˮ��Һ�����ԣ������ӷ���ʽ������ԭ�� ��
��5����֪1mol e �ĵ���������d2��ȼ�գ��ָ������£��ų�255.5kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
���𰸡�
��1���������ڢ�A�壻![]()
��2��r��N3������r��O2������r��Na+����r��Al3+����HClO4
��3��![]()
��4��NH4++H2O?NH3��H2O+H+
��5��2Na��s��+O2��g��=Na2O2��s����H=��511kJ?mol��1
���������⣺��ͼ�еĻ��ϼۡ�ԭ�Ӱ뾶�Ĵ�С��ԭ����������֪x��HԪ�أ�y��CԪ�أ�z��NԪ�أ�d��OԪ�أ�e��NaԪ�أ�f��AlԪ�أ�g��SԪ�أ�h��ClԪ�أ���1��f��AlԪ�أ���Ԫ�����ڱ���λ���ǵ������ڢ�A�壻S2�����ӽṹʾ��ͼΪ ![]() �����Դ��ǣ��������ڢ�A�壻
�����Դ��ǣ��������ڢ�A�壻 ![]() ����2�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��r��N3������r��O2������r��Na+����r��Al3+�����ǽ�����S��Cl���ǽ�����Խǿ�����������ˮ���������Խǿ�������ԣ�HClO4��H2SO4 �� ���Դ��ǣ�r��N3������r��O2������r��Na+����r��Al3+����HClO4����3����H��NԪ�����һ����ԭ�ӹ��ۻ�����ΪNH3 �� ����ʽΪ��
����2�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�������Ӱ뾶��r��N3������r��O2������r��Na+����r��Al3+�����ǽ�����S��Cl���ǽ�����Խǿ�����������ˮ���������Խǿ�������ԣ�HClO4��H2SO4 �� ���Դ��ǣ�r��N3������r��O2������r��Na+����r��Al3+����HClO4����3����H��NԪ�����һ����ԭ�ӹ��ۻ�����ΪNH3 �� ����ʽΪ�� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����4����H��N��Cl����Ԫ�ع��ɵ��Σ���ˮ��Һ�����ԣ�����ΪNH4Cl��笠�����ˮ�⣺NH4++H2ONH3��H2O+H+ �� ��Һ�����ԣ����Դ��ǣ�NH4++H2ONH3��H2O+H+����5������������ȼ�����ɹ������ƣ���Ӧ����ʽΪ��2Na+O2
����4����H��N��Cl����Ԫ�ع��ɵ��Σ���ˮ��Һ�����ԣ�����ΪNH4Cl��笠�����ˮ�⣺NH4++H2ONH3��H2O+H+ �� ��Һ�����ԣ����Դ��ǣ�NH4++H2ONH3��H2O+H+����5������������ȼ�����ɹ������ƣ���Ӧ����ʽΪ��2Na+O2 ![]() Na2O2 �� 2mol�Ʒ�Ӧ�ų��ų�������Ϊ255.5kJ��2=511kJ����Ӧ�Ȼ�ѧ����ʽΪ��2Na��s��+O2��g��=Na2O2��s����H=��511kJmol��1 �� ���Դ��ǣ�2Na��s��+O2��g��=Na2O2��s����H=��511kJmol��1 ��
Na2O2 �� 2mol�Ʒ�Ӧ�ų��ų�������Ϊ255.5kJ��2=511kJ����Ӧ�Ȼ�ѧ����ʽΪ��2Na��s��+O2��g��=Na2O2��s����H=��511kJmol��1 �� ���Դ��ǣ�2Na��s��+O2��g��=Na2O2��s����H=��511kJmol��1 ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����Ҫ�Ļ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ��������˵��������ǣ� �� 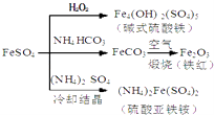
A.��ʽ������ˮ���ܲ���Fe��OH��3���壬��������ˮ��
B.Ϊ��ֹNH4HCO3�ֽ⣬����FeCO3���ڽϵ��¶��½���
C.����KSCN��Һ���飨NH4��2Fe��SO4��2�Ƿ�����
D.�����£���NH4��2Fe��SO4��2��FeSO4������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��S02�ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
(1)��֪�� ��NO2+CO![]() CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H=+179.5kJ/mol K2
2NO(g) ��H=+179.5kJ/mol K2
��2NO(g)+O2(g)![]() 2NO2(g) ��H=-112.3kJ/mol K3
2NO2(g) ��H=-112.3kJ/mol K3
д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ����ʽ____________________________________�����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=_________(��K1��K2��K3��ʾ)��
(2)������ɱ�ĺ�ѹ(p��)�ܱ������г���1molCO2 ��������̼�����䷢����Ӧ�� C(s)+ CO2(g)![]() 2CO(g) ��H>0��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g) ��H>0��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
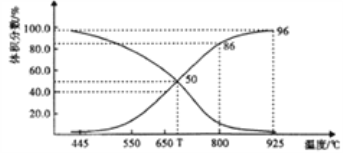
��T��ʱ����������������ϡ�����壬v(��)___v(��)(�>����<����=")��ƽ��______�ƶ�(���������������ͬ)��������������CO2 ��CO��ƽ��________�ƶ���
��CO�������Ϊ40%ʱ��CO2 ��ת����Ϊ_______��
����֪�������ѹ(p��)=������ѹ�������������ƽ���ѹ����ƽ��Ũ�ȱ�ʾƽ��Kp�����ı���ʽΪ__________��925��ʱ��Kp=______(�ú�p���Ĵ���ʽ��ʾ)��
(3)ֱ���ŷź�SO2 ���������γ����꣬Σ������������NaOH���գ����ú������(H2SO3��HSO3-��SO32-)�����ڷ�Ӧ�����Һ�У����ǵ����ʵ�������X(i)����ҺpH�Ĺ�ϵ��ͼ��ʾ��

������0.1mol/LNaOH ��Ӧ�����Һ�������Һ��pH=8ʱ����Һ�и�����Ũ���ɴ�С��˳����______________��
����pH=5��NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2 ��Һ����Һ�г��ֻ��ǣ�pH��Ϊ2���û�ѧƽ���ƶ�ԭ��������ҺpH���͵�ԭ��_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������VB2����������ع���ʱ��ӦΪ��4VB2+ 11O2= 4B2O3+ 2V2O5���øõ��Ϊ��Դ��ѡ�ö��Ե缫�������ͭ��Һ��ʵ��װ����ͼ��ʾ�������·��ͨ��0.04mol����ʱ��Bװ���ڹ��ռ���0.448L���壨��״������������˵����ȷ����
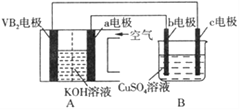
A. VB2�缫�����ĵ缫��ӦΪ��2VB2+ 11H2O - 22e-= V2O5+ 2B2O3+ 22H+
B. ���·�е�����c�缫����VB2�缫
C. �������У�c�缫�������к�ɫ����������b�缫�����ݲ���
D. ��Bװ���ڵ�Һ�����Ϊ200 mL����CuSO4��Һ�����ʵ���Ũ��Ϊ0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��Cl-��Br-��I- �������ʵ���֮����1��2��3��ͨ��һ������Cl2 ������Ӧ��ɺñ�ֵ��Ϊ3��2��1����Ӧ��Cl2��ԭ��Һ��I-�����ʵ���֮����
A. 1��2 B. 1��4 C. 1��3 D. 1��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧʵ����ȤС���ڡ�̽��±�ص��ʵ������ԡ���ϵ��ʵ���з��֣���������ϡ�Ȼ�������Һ�У�����1��2����ˮ������Һ�ʻ�ɫ��
��1��������⣺Fe3+��Br2�ĸ������Ը�ǿ�� ���룺�ټ�ͬѧ��Ϊ�����ԣ�Fe3+��Br2 �� ������ʵ�������Ƿ���������ԭ��Ӧ���£�����Һ�ʻ�ɫ�Ǻ����ѧʽ����ͬ�����£�
����ͬѧ��Ϊ�����ԣ�Br2��Fe3+ �� �����������Ƿ���������ԭ��Ӧ���£�����Һ�ʻ�ɫ�Ǻ����£�
��2�����ʵ�鲢��֤��ͬѧΪ��֤��ͬѧ�Ĺ۵㣬ѡ������ijЩ�Լ���Ƴ����ַ�������ʵ�飬��ͨ���۲�ʵ������֤������ͬѧ�Ĺ۵�����ȷ�ģ� ��ѡ�õ��Լ���a����̪��Һ b��CCl4 c����ˮ�ƾ� d��KSCN��Һ��
�����ڱ���д����ͬѧѡ�õ��Լ���ʵ���й۲쵽������
ѡ���Լ�������ţ� | ʵ������ | |
����1 | ||
����2 |
��3������ �����ԣ�Br2��Fe3+ �� ����������ϡ�Ȼ�������Һ�У�����1��2����ˮ����Һ�ʻ�ɫ�����������ӷ�Ӧ����ʽΪ ��
��4��ʵ����˼�� �ٸ�������ʵ���Ʋ⣬�����廯������Һ��ͨ�����������ȱ������������� ��
����100mLFeBr2��Һ��ͨ��2.24LCl2����״��������Һ���� ![]() ��Br���������ɵ���Br2 �� ��ԭFeBr2��Һ�����ʵ���Ũ��Ϊ ��
��Br���������ɵ���Br2 �� ��ԭFeBr2��Һ�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��K�����µ�ת����ϵ������D��EΪ���嵥�ʣ��Իش�ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ��������� 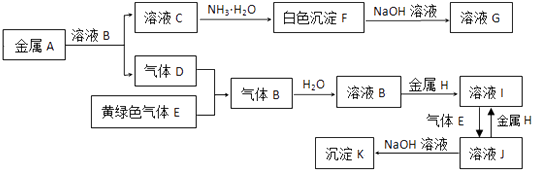
��1��д���������ʵĻ�ѧʽ��D�� �� G����
��2��д����C��F����Ӧ�����ӷ���ʽ��
��3��д����Ӧ��F��G�������ӷ���ʽ��
��4��д����Ӧ��I��J�������ӷ���ʽ��
��5������ҺI�е���NaOH��Һ���ɹ۲쵽����������д����صĻ�ѧ��Ӧ����ʽ ��
��6����200mL 3mol/L��ҺJ�м���60g����ͭ��������ͭ�����ʵ�����Ϊ1��1������ַ�Ӧ����ˣ�����Һ��ͨ�������İ�������ַ�Ӧ���ٹ��ˡ�ϴ�ӡ�������գ����պ�õ����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������Ħ���棬���ӽṹ��ͼ��ʾ�������й���������˵����ȷ���ǣ� ��
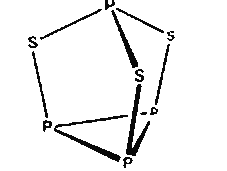
A. ����������Ԫ�صĻ��ϼ�Ϊ+3
B. 22 g P4S3����ԭ����ĿԼΪ1.806��1023
C. �����ʷ��ӽṹ��S��P��������������Ϊ8
D. �����ʷ�����ȫ�Ǽ��Թ��ۼ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com