

分析 浓氨水在氧化钙或氢氧化钠、碱石灰等作用下可放出大量的氨气,B中碱石灰用于干燥氨气,加热条件下,氨气与CuO发生氧化还原反应生成氮气和铜,D中碱石灰用于吸收水,E用于吸收氨气,F用于测量生成氮气的体积,测量气体体积时量气管液面应相等,以排除压强的影响,以此解答该题.
解答 解:(1)装置中仪器a为分液漏斗,故答案为:分液漏斗;
(2)利用装置A,可制取的无色气体;
A.制备氯气Cl2需要加热,且氯气为黄绿色气体,故A错误;
B.可以制备O2,利用固体过氧化钠和水的反应,故B正确;
C.可以制备CO2 气体,利用稀盐酸滴入大理石上反应生成,故C正确;
D.NO2是红棕色气体,故D错误;
故答案为:BC;
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2 ,故答案为:还原;3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+3H2O+N2 ;
(4)进入D中的气体有氨气、氮气和水,碱石灰只能用于吸收反应生成的水,故答案为:吸收反应生成的水;
(5)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(6)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数,
故答案为:慢慢上下移动右边漏斗,使左右两管液面相平.
点评 本题考查较为综合,为高频考点,题目涉及氨气的实验室制备,性质验证和反应现象分析判断判断,装置流程分析,量气装置的使用方法,题目难度中等.试题有利于培养学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 该晶体类型是分子晶体 | |
| B. | 该晶体的空间最小环共有六个原子构成 | |
| C. | 晶体中碳原子数与C-O键数之比为1:2 | |
| D. | 该晶体中碳原子和氧原子的个数比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
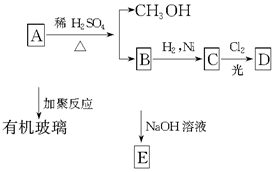
 请回答:
请回答: .
. +Br2→CH2BrC(CH3)BrCOOH
+Br2→CH2BrC(CH3)BrCOOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )| A. | C元素是非金属性最强的元素 | |
| B. | A元素最高价氧化物对应的水化物具有强氧化性 | |
| C. | 三种元素的原子半径的大小顺序是:B>C>A | |
| D. | B元素的氧化物、氢化物的水溶液都呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的球棍模型: | |
| B. | NH3的电子式: | |
| C. | H、${\;}_{\;}^{1}$H、${\;}_{\;}^{2}$H、${\;}_{\;}^{3}$H互为同位素 | |
| D. | 融融状态下NaSO4的离子方程式为NaHSO4═Na++HSO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )| A. | 用溴水可以区分苯、四氯化碳、环己烯 | |
| B. | 苯中的化学键是介于单键与双键之间的化学键,不能发生加成反应 | |
| C. | 苯和溴水在三溴化铁做催化剂下发生取代反应,一定条件下能与氢气发生加成反应 | |
| D. | 苯与硝酸在浓硫酸催化下加热生成硝基苯,苯也能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用布袋购物、以步代车属于“低碳生活”方式 | |
| B. | 饮用水中矿物质的含量越高越有利于人体健康 | |
| C. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入5 mL 0.01mol/L NaOH,所得溶液中离子的浓度一定符合:c(Na+)+c(H+)═c(OH-)+c(ClO-) | |
| B. | 25℃时,若溶液的pH=5,则Ka(HClO)=l×10-7 | |
| C. | 向溶液中加入少量NH4Cl固体,溶液中$\frac{c(HClO)}{c(Cl{O}^{-})}$的值变小 | |
| D. | 向溶液中加入10 mL O.01mol/L NaOH,所得溶液中离子浓度的大小顺序为:c(Na+)>c(ClO-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com