
【题目】25℃时,在2L 0.3mol/L的HF溶液中,有0.02mol的HF电离成离子,求该温度下HF的电离常数。_____________
科目:高中化学 来源: 题型:
【题目】现有下列4种有机物:①CH4 ②CH2=CH2 ③CH3CH2CH2CH3 ④CH3CH2OH ⑤葡萄糖
(1)与①互为同系物的是______(填序号)。
(2)写出④的官能团名称为 _________________ 。
(3)写出③的同分异构体的结构简式_______。
(4)写出③的二氯代物有____________种.
(5)糖尿病通常是指病人尿液中_________的含量高。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的纯净、干燥的气体 (考虑尾气吸收)。关于这些装置的连接方法正确的是 ( )

A. 实验室用石灰石与稀盐酸制备收集CO2:b→f→d→e
B. 实验室用锌粒与稀硫酸制备收集H2:b→c→g
C. 实验室利用H2O2与二氧化锰制备收集O2:a→c→e
D. 实验室用浓氨水与生石灰反应制备收集NH3:b→d→e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量氯水加入KI溶液中,充分反应后,再加入苯,振荡,静置后观察到的现象是
A. 液体呈黄色,不分层 B. 有紫黑色固体析出
C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有反应X(g)+Y(g)![]() 2Z(g) △H<0,若反应开始经t1后达到平衡,又经t2后由于反应条件的改变使平衡破坏,到t3时又达平衡(如图所示),t2~t3曲线变化的原因是
2Z(g) △H<0,若反应开始经t1后达到平衡,又经t2后由于反应条件的改变使平衡破坏,到t3时又达平衡(如图所示),t2~t3曲线变化的原因是
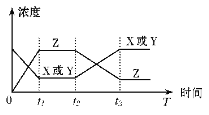
A. 增大了X或Y的浓度
B. 使用了催化剂
C. 增加了反应体系的压强
D. 升高了反应的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况体积相等时,反应中消耗的H2SO4和NaOH物质的量之比为( )
A.1:4B.2:3C.3:2D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________mol,转移的电子的数目约为____________。
II.根据反应Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______。
②氧化剂与氧化产物的物质的量之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
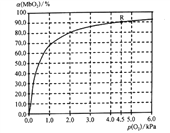
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com