
| A. | 熵增加且放热的反应一定是自发反应 | |
| B. | X?Y+Z正反应吸热,则逆反应必然放热 | |
| C. | 化学反应的焓变△H越大,表示放热越多 | |
| D. | 稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ |
分析 A.反应自发进行的判断依据是△H-T△S<0,由反应的焓变,熵变,温度共同决定;
B.△H=生成物的能量和-反应物的能量和;
C.反应焓变为负值是放热反应,焓变为正值为吸热反应;
D.稀溶液中,强酸强碱中和反应生成1mol水放热为57.3 kJ,若为弱酸或弱碱,存在电离平衡吸热,放出的热量减小,若中和反应生成沉淀会存在沉淀热等;
解答 解:A.熵增加△S>0,且放热△H<0,反应△H-T△S<0一定是自发反应,故A正确;
B.△H=生成物的能量和-反应物的能量和,所以其逆反应的反应热是其相反数,正反应吸热,则逆反应必然放热,故B正确;
C.反应焓变为负值是放热反应,焓变为正值为吸热反应,若是放热反应,化学反应的焓变△H越大,表示放热越少,故C错误;
D.稀溶液中,强酸强碱中和反应生成1mol水放热为57.3 kJ,若为弱酸或弱碱,存在电离平衡吸热,放出的热量减小,若中和反应生成沉淀会存在沉淀热,放出的热量会增大,稀溶液中,酸碱中和反应生成1 mol H2O时放热不一定为57.3 kJ,故D正确;
故选C.
点评 本题考查了反应能量变化、反应自发进行的判断依据、反应焓变的分析和计算与应用,注意中和热是强酸强碱稀溶液生成1mol水放出的热量,反应无沉淀生成,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在6种微粒 | |
| B. | c(Na+)=c(HClO)+2c(ClO-) | |
| C. | c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| D. | 往所得中性溶液中加入NaHCO3能放出大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
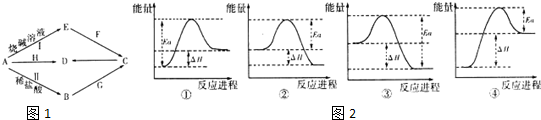
 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O.| 化学键 | O=O(g) | H-H(g) | H-O(g) |
| 键能/kJ•mol-1 | 496 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
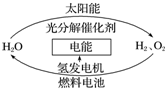 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想如图所示.下列说法正确的是( )| A. | 氢能源已被普遍使用 | |
| B. | H2O的分解反应是吸热反应 | |
| C. | 氢气不易贮存和运输,无开发利用价值 | |
| D. | 2 mol 液态H2O具有的总能量高于2 mol H2和1 mol O2的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
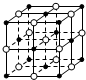
| A. | 含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA | |
| B. | 23.4 g NaCl晶体中含有0.1NA个右图所示的结构单元 | |
| C. | 常温常压下,5 g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 2 mol SO2和1 mol O2在一定条件下反应所得混合气体分子数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-11mol/L | B. | 1×10-3mol/L | C. | 1×10-7mol/L | D. | 0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com