
 ;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O分析 (1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为 ,在离子反应方程式中单质、气体、水应保留化学式;
,在离子反应方程式中单质、气体、水应保留化学式;
(2)根据物质所含元素的化合价的变化判断氧化剂、氧化产物以及参加氧化还原反应的硝酸的物质的量;
解答 解:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为 ,在3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O反应中,HNO3和Cu(NO3)2溶于水且电离,应写成离子的形成,改写后的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:
,在3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O反应中,HNO3和Cu(NO3)2溶于水且电离,应写成离子的形成,改写后的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为: ;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)在3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价由0价升高为+2价,为还原剂,被氧化,氧化产物为Cu(NO3)2,HNO3中N元素的化合价由+5价降为+2价,被还原,为氧化剂,反应中产生Cu(NO3)2的HNO3没有参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的$\frac{6}{8}$=$\frac{3}{4}$,
故答案为:$\frac{3}{4}$.
点评 本题考查氧化还原反应,明确元素的化合价变化及原子守恒的方法来分析是解答本题的关键,并注意反应中化学计量数与转移电子数目的关系来解答即可.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 这个过程只涉及物理变化 | |
| B. | 这个过程是可逆反应 | |
| C. | 这个过程发生了复分解反应 | |
| D. | “丹砂烧之成水银”过程中还可能产生SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应:2 Fe+6H+═2Fe3++3 H2↑ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 碳酸氢钠溶液中滴入NaOH溶液:HCO3-+OH-═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、Cl2、SO2使品红溶液褪色原理不同 | |
| B. | Na2O2和SO2反应时,过氧化钠既作氧化剂又作还原剂 | |
| C. | 为了褪色更快,可同时向品红溶液通入等物质的量Cl2和SO2 | |
| D. | 可用H2S溶液来区别Cl2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
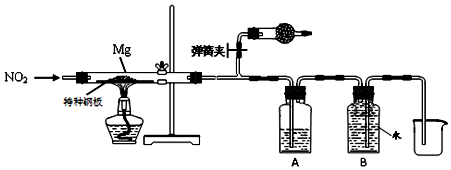
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑧ | B. | 只有⑤ | C. | 只有③ | D. | ②⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com