25℃时有pH=12的NaOH溶液100mL,要使它的pH为11.(体积变化忽略不计)
(1)如果加入蒸馏水,应加______mL;
(2)如果加入pH=10的NaOH溶液,应加______mL;
(3)如果加0.01mol/L 盐酸,应加______mL;
(4)如果加0.01mol/L 醋酸,所加体积比0.01mol/L 盐酸所用体积______(填“多”、“少”、“一样”)
【答案】
分析:(1)根据溶液稀释前后,溶质的物质的量不变计算;
(2)当碱和碱混合时,根据c(OH
-)=

计算;
(3)当盐酸与氢氧化钠溶液混合反应时,先计算溶液剩余的氢氧根离子,根据c(OH
-)=
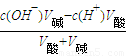
计算需要盐酸的体积;
(4)利用(3)进行对比进行分析解答.
解答:解:pH=12的NaOH溶液中c(OH
-)=0.01mol/L,pH降为11,则溶液中c(OH
-)=0.001mol/L,
(1)(1)设加入水的体积为xL,
溶液稀释前后溶质的物质的量不变,则
0.01mol/L×0.1L=0.001mol/L×(0.01+x)L,
x=0.9L,即900ml,
故答案为:900;
(2)pH=10的氢氧化钠溶液中c(OH
-)=0.0001mol/L,
设pH=10的氢氧化钠的体积为yL,则0.01mol/L×0.1L+0.0001mol/L×yL=0.001mol/L×(0.1+y)L,y=1L=1000mL,
故答案为:1000;
(3)设加入0.01mol/L的盐酸体积为zL,则
0.01mol/L×(0.1-z)L=0.001mol/L×(0.1+z)L
z=0.081.8L=81.8mL,故答案为:81.8;
(4)假设醋酸是强酸,则需要加入的醋酸和盐酸的体积相同,实际上,醋酸是弱酸,则加入的醋酸要多余81.8mL时,溶液的pH才能为11,故答案为:多.
点评:本题考查pH的简单计算,注意酸碱混合时溶液pH的计算方法,注意浓度与pH的关系为易错点.

 计算;
计算;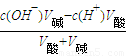 计算需要盐酸的体积;
计算需要盐酸的体积;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案