
����Ŀ����һ������CO2����ͨ��2Lδ֪Ũ�ȵ�NaOH��Һ�У���������Һ����μ���ϡ������������������Һ���ȣ�������������HCl�����ʵ����Ĺ�ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ���������˵������ȷ����
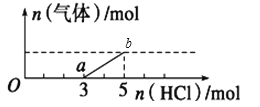
A.O����Һ���������ʵĻ�ѧʽΪNaOH��Na2CO3
B.a����Һ����ʹ��̪��Һ���
C.��״���£�ͨ��CO2�����Ϊ44.8L
D.ԭNaOH��Һ�����ʵ���Ũ��Ϊ5mol/L
���𰸡�D
��������
A��Na2CO3������ķ�Ӧ�Ƿֲ����еģ�Na2CO3+HCl=NaHCO3+NaCl��NaHCO3+HCl=NaCl+H2O+CO2����HCl��Na2CO3��NaHCO3����1:1��Ӧ����ͼ���֪���ɶ�����̼���ĵ�HCl�����ʵ���С�ڴӷ�Ӧ����ʼ����������̼�����ĵ�HCl������Һ������ΪNaOH��Na2CO3����A��ȷ��
B��a����Һ������Ϊ̼�����ƣ�̼��������Һ�Լ��ԣ���ʹ��̪��Һ��죬��B��ȷ��
C����ͼ��֪��a��ʱ��ʼ�������壬�ʷ�����ӦΪ��NaHCO3+HCl=NaCl+H2O+CO2���������ɶ�����̼������ʱ���ý����ĵ�HCl�����ʵ���Ϊ2mol����ԭ���غ��֪����������̼�����ʵ���Ϊ2mol�����ɵĶ�����̼�����ʵ������ڿ�ʼͨ��Ķ�����̼�����ʵ������ʿ�ʼͨ��Ķ�����̼�����Ϊ2mol��22.4L/mol=44.8L����C��ȷ��
D������5molHCl���ɶ�����̼������ʱ��Һ������ΪNaCl�������������غ���n(NaCl)=n(HCl)�������������غ���n(NaOH)=n(NaCl)����n(NaOH)=n(HCl)=5mL������c(NaOH)=![]() =2.5mol/L����D��ȷ��
=2.5mol/L����D��ȷ��
�ʴ�ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A. ʯ�ͷ������������Ʊ�����ϩ����ȡ���¶ȼƵ�λ�ö�����ͬ
B. �����ʵ������Һ�м�ˮ���ɹ۲쵽��Һ������Ϊ�б��㡢ˮ����屽��
C. ±������±ԭ�ӵļ��飬������±����ˮ���IJ�����ֱ�ӵμ�![]() ��Һ
��Һ
D. �Ҵ���Ũ���ᷴӦ���Ƶõ�����ͨ�뵽��ˮ�У�����ˮ��ɫ����֤������ϩ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǻ������������㷺����ʳƷ����ױƷ��ҽҩ������ij��ѧ��ȤС��ͨ���������ף��Ʊ��ǻ��������������ش��������⣺
(һ)���ǻ������������ĺϳ�
ʵ��ԭ����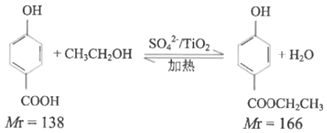
ʵ�鲽�裺ȡ0.4mol�Ҵ��ʹ������ڸ��������A�У�0.1mol���ǻ����������ں�ѹ��Һ©��C�У�ʵ��װ����ͼ��ʾ(���Ⱥͼг�װ��ʡ��)�����Ȼ�������ַ�Ӧ��
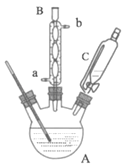
(1)����A��������_____������B������ˮ������Ϊ��_____(��a����b��)ͨ�롣
(2)ijͬѧ��������A������������֮���һ����ˮװ�ã��û�ѧƽ��ԭ���������������ŵ���_____��
(3)ȡ����2g�����ǻ�������0.1mol���Ҵ�0.4mol����Ӧ���������IJ����뷴Ӧʱ��Ĺ�ϵ���±���ʾ��
��Ӧʱ��/Сʱ | 1 | 3 | 4 | 5 | 6 |
���IJ���/% | 45.6 | 88 | 91.8 | 91.1 | 90.8 |
���ݱ������ݿ�֪����ѷ�Ӧ��ʱ��ӦΪ_____����Ӧʱ����������������½��Ŀ���ԭ����_____��
(��)���ǻ������������ľ���
ʵ�鷽�����ٷ�Ӧ��Ϻ�����˳���������Һ������ˮ�У��������壬���ˡ�
�ڹ����Ⱥ���5%��Na2CO3��Һ��ˮϴ�ӣ������õ��ֲ�Ʒ��
����װ�������ܵ�Բ����ƿ�У�����һ�����������Ʒ�����Ҵ���ˮ�ͻ���̿�����Ȼ���0.5Сʱ�����ȳ��ˣ���Һ��ȴ��������ɫ���壬��80���ɡ�
(4)�ڢ�����5%��Na2CO3��Һϴ�ӵ�Ŀ����_____���ܲ�����NaOH��Һ�����_____(��ܡ����ܡ�)��
(5)�ڢ۳��ȳ�����Ҫ��ȥ������Ϊ_____�������ȡ���Ŀ����_____��
(6)��С��ͬѧ��(3)������Ͷ�ϣ����õ����ǻ�����������14.9g�����ʵ��IJ���Ϊ_____%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ����ֱ��ˮ�Ϸ�C2H4(g)��H2O(g)![]() C2H5OH(g)����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ[����n(H2O)��n(C2H4)��1��1]��
C2H5OH(g)����ϩ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ[����n(H2O)��n(C2H4)��1��1]��
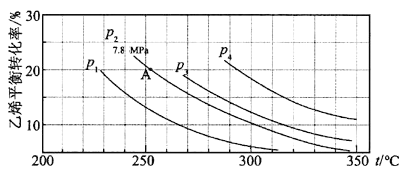
������ϩˮ�����Ҵ���Ӧ��ͼ��A���ƽ�ⳣ��KpΪ (��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
A.0.082B.0.072C.0.072MPa-1D.0.082 MPa-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӧ���ڴ�������ͨ���������������̽��еġ��ҹ�ѧ�߷���T��ʱ�������ʾ�Ϊ��̬�����״���ˮ��ͭ�������ϵķ�Ӧ����������ͼ��ͼ��
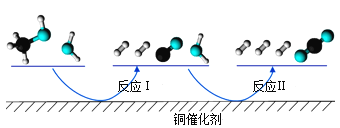
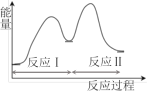
����˵����ȷ���ǣ� ��
A.��Ӧ����Ȼ�ѧ����ʽΪ��CO(g)+H2O(g)=H2(g)+CO2(g) ��H=+akJ/mol(a>0)
B.1molCH3OH(g)��1molH2O(g)������������1molCO2(g)��3molH2(g)��������
C.ѡ�������Ĵ������ͷ�Ӧ��͢�Ļ�ܣ������ڼ��ٹ����е��ܺ�
D.CO(g)�ڷ�Ӧ�����������ģ�CO(g)����Ϊ�Ǵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӻ�ѧ������չ����ѧ�ĸ�����֧������չ��������ѧ������ѧ��������Mo��2��C60���ӡ�2��p�����ᶡ����़�2��CO����������λ������װ�ij����ӽṹ��ͼ��ʾ��

(1)Mo���ڵ������ڵ�VIB�壬��������Ų���Cr���ƣ����Ļ�̬�۵����Ų�ʽ��___________������δ�ɶԵ�������___________����
(2)�ó������д��ڵĻ�ѧ��������___________��
A ���� B �м� C ���Ӽ� D ���
(3)�ó�����������CO�ṩ�µ��ӶԵ�ԭ����___________(��Ԫ�ط���)��p�����ᶡ�����������Cԭ�ӵ��ӻ���ʽ��___________��
(4)�ӵ縺�ԽǶȽ���CF3COOH������ǿ��CH3COOH��ԭ��___________��
(5)C60����ʯ��Ϊͬ�������壬�ӽṹ������֮��Ĺ�ϵ����C60���۵�Զ���ڽ��ʯ��ԭ����___________��
(6)��֪��ij�����и�ԭ�ӵ����λ�ÿ�����ͼ��ʾ��ԭ�������ʾ���������ж���ԭ�������Ϊ(0��0��0)��

��(Mo)��һ��������ϵ�ľ���ṹ�У�ÿ��������2��Moԭ�ӣ�����Moԭ��������(0��0��0)��(1/2��1/2��1/2)������������Ϣ���ƶϸþ����ԭ�Ӷѻ���ʽ��___________����֪�þ�����ܶ��Ǧ�g��cm��3��Mo��Ħ��������M g��mol��1�������ӵ�������NA�������о��������Moԭ�Ӻ�֮��ľ���Ϊ___________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.1mol/L��NH4Cl��Һ�У�����Ũ�ȹ�ϵ��ȷ����
A.c(![]() )>c(Cl��)>c(H+)>c(OH��)
)>c(Cl��)>c(H+)>c(OH��)
B.c(![]() )>c(OH��)>c(Cl��)>c(H+)
)>c(OH��)>c(Cl��)>c(H+)
C.c(OH��)=c(Cl��)+c(H+)
D.c(![]() )+c(H+)=c(Cl��)+c(OH��)
)+c(H+)=c(Cl��)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����![]()
A.��ϡ��ˮ��μ���ϡ�����У�����Һ��![]() ʱ��
ʱ��![]()
B.���ִ�����Һ�����ʵ���Ũ�ȷֱ�Ϊ![]() ��
��![]() ��pH�ֱ�Ϊa��
��pH�ֱ�Ϊa��![]() ����
����![]()
C.![]() ��NaOH��Һ��
��NaOH��Һ��![]() �Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ
�Ĵ�����Һ�������ϣ�����ʯ����Һ�ʺ�ɫ
D.��![]() �İ�ˮ�м�����������粒��壬����Һ��
�İ�ˮ�м�����������粒��壬����Һ�� ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����300 mL���ܱ������У��������۲�����һ������CO���壬һ�������·�����Ӧ��Ni(s)��4CO(g) ![]() Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�����ʾ��
Ni(CO)4(g)����֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�����ʾ��
�¶�/�� | 25 | 80 | 230 |
ƽ�ⳣ�� | 5��104 | 2 | 1.9��10��5 |
����˵����ȷ����(����)
A. ��������Ni(CO)4(g)�ķ�ӦΪ���ȷ�Ӧ
B. 25 ��ʱ��ӦNi(CO)4(g) ![]() Ni(s)��4CO(g)��ƽ�ⳣ��Ϊ0.5
Ni(s)��4CO(g)��ƽ�ⳣ��Ϊ0.5
C. ��80 ��ʱ�����ijʱ�̣�Ni(CO)4��COŨ�Ⱦ�0.5 mol/L�����ʱv��>v��
D. 80 ���ﵽƽ��ʱ�����n(CO)��0.3 mol����Ni(CO)4��ƽ��Ũ��Ϊ2 mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com