
【题目】下列变化中,一定需加还原剂才能实现的是( )
A.CO2→CO32-B.FeCl3→FeCl2C.C→CO2D.Na2O2→O2
科目:高中化学 来源: 题型:
【题目】在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: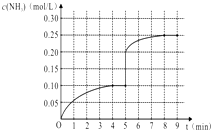
(1)该反应的化学平衡常数表达式为;
(2)根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= .
(3)该反应达到平衡状态的标志是(填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( ) 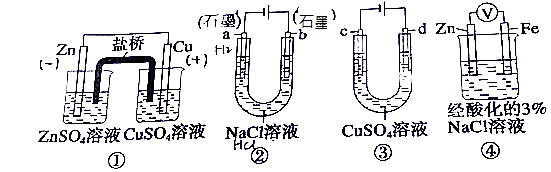
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①CH3COOH ②Na2C2O4③NaCl ④NaOH⑤NH4Cl.回答问题:
(1)H2C2O4是弱酸,则②溶液中盐水解的离子方程式为;
(2)浓度均为 0.1molL﹣1 的④、⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3H2O)=;
(3)常温下,pH都为4的①、⑤溶液中水电离出的c(OH﹣)的比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C三种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②填充模型为: |
B | ①可以从煤干馏生成的煤焦油中提取;②填充模型为: |
C | ①工业生产中可通过A与H2O加成获得;②相对分子质量为46 |
请结合信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的反应类型为______。
(2)B与浓硝酸发生反应的化学方程式为________________。
(3)写出C的同分异构体______________。
(4)①C与乙酸可反应生成酯,其化学方程式为______;
②反应装置如图,a试管中碎瓷片的作用是_______;试管b中的试剂是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应可以为人类提供能源,也可用来解决环境问题。
(1)已知某些化学键的键能数据如下:
化学键 | H-H | O=O | O-H |
键能kJ·mol-1 | 436 | 495 | 463 |
①写出H2与O2反应生成水蒸气的热化学方程式____________;
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为_____%(结果保留三位有效数字)。
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。

①阴极区的pH______(填“升高”或“降低”);
②阳极发生的电极反应式为__________;
③当电路中通过1mol电子的电量时,阴极上生成气体的体积为_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是种重要的工业原料,可用于制备补血剂乳酸亚铁。某研究小组 通过下列实验,寻找利用复分解反应制各FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNa2CO3溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,后出现明显的红褐色 |
0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅱ: 产生白色沉淀及少量无色气泡,2min,后出现明显的灰绿色 | |
0.8mol/L(NH4)2Fe(SO4)2溶液(pH=4.0) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅲ: 产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中产生HCO3-和红褐色沉淀的离子方程式为___________
(2)实验Ⅱ中产生FeCO3的离子方程式为___________
(3)为了探究实验Ⅲ中NH4+所起的作用,甲同学设计了实验Ⅳ进行探究:
操作 | 现象 | |
实验Ⅳ | 向0.8mol/LFeSO4溶液中加入_____,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL1mol/LNaHCO3溶液混合 | 与实验Ⅲ现象相同 |
实验Ⅳ中加入Na2SO4固体的目的是_____
对比实验Ⅱ、Ⅲ、Ⅳ,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是_____.再取该溶液一滴管2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高。需要利用如图所示的装置进行定量测定。

分别将实验Ⅰ、Ⅱ、Ⅲ中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。反应完成后通入N2的作用是_______。为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是_________
(5)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ。通过以上实验分析。制备FeCO3实验成功的关键因素是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(Lmin).求:
(1)此时A的浓度c(A)=mol/L,反应开始前容器中的A,B的物质的量:n(A)=n(B)=mol;
(2)B的平均反应速率v(B)=mol/(Lmin);
(3)x的值为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com