
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | Z、W形成化合物的电子式为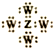 | |
| D. | X、W分别形成的氢化物中所含化学键种类相同 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,Z元素在地壳中的含量居于第二位,则Z为Si元素;四种元素同周期,X的金属性在同周期元素中最强,则X为Na元素;Y原子的电子层数与最外层电子数相等,则Y最外层含有3个电子,为Al元素;W的最高价氧化物的水化物的化学式为HnWO2n+2,设W的最高正化合价为x,则x+n=4n+4,则x=3n+4,n只能为1,即其最高正化合价为+7,故W为Cl元素,以此解答该题.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,Z元素在地壳中的含量居于第二位,则Z为Si元素;四种元素同周期,X的金属性在同周期元素中最强,则X为Na元素;Y原子的电子层数与最外层电子数相等,则Y最外层含有3个电子,为Al元素;W的最高价氧化物的水化物的化学式为HnWO2n+2,设W的最高正化合价为x,则x+n=4n+4,则x=3n+4,n只能为1,即其最高正化合价为+7,故W为Cl元素,
A.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径大小:Y<X<W,故A错误;
B.Y的氧化物为氧化铝,Z的氧化物为二氧化硅,氧化铝具有两性,而二氧化硅为酸性氧化物,故B错误;
C.Z、W形成化合物为四氯化碳,四氯化碳的电子式为 ,故C正确;
,故C正确;
D.X的氢化物为NaH,W的氢化物为HCl,NaH含有离子键,而HCl中含有共价键,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,正确推断元素为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
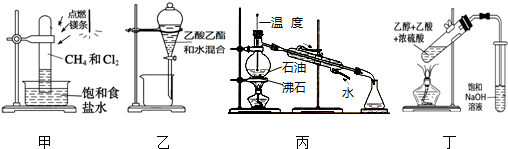
| A. | 用装置甲在强光照条件下制取一氯甲烷 | |
| B. | 用装置乙分离乙酸乙酯和水 | |
| C. | 用装置丙蒸馏石油并收集60~150℃馏分 | |
| D. | 用装置丁制取并收集乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA | |
| B. | 高温下,0.2molFe与足量水蒸气反应,转移电子数目为0.6NA | |
| C. | 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
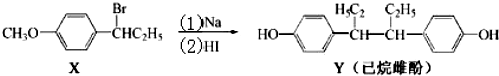
| A. | 化合物X 的分子式为C9H13BrO | B. | 化合物X苯环上的一溴代物有四种 | ||
| C. | 用FeCl3溶液可鉴别化合物X和Y | D. | 反应(2)属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2>Fe(OH)3 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或CCl4中所含的共价键数均为0.4NA | |
| B. | S2和S8的混合物共6.4g,其中所含的电子数一定为3.2NA | |
| C. | 5.4gAl分别于含溶质0.2mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移4 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com