
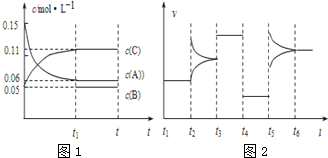
| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
| △c |
| △t |
| △c |
| △t |
| 0.11-0.05 |
| 15 |


科目:高中化学 来源: 题型:
| A、Na+、NH4+、Cl-、CH3COO- |
| B、K+、Fe2+、SO42-、NO3- |
| C、Na+、K+、CO32-、ClO- |
| D、Al3+、Cu2+、SO42-、HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:
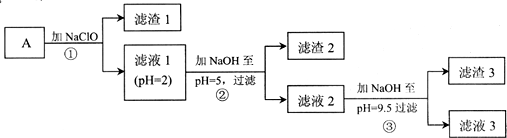
| 物质 | 开始沉淀的pH | 沉淀完全的pH | Kap(25℃) |
| Fe(OH)3 | 2.7 | 3.7 | 4.0×10-38 |
| Fe(OH)2 | 7.6 | 9.6 | 8.0×10-16 |
| Ni(OH)2 | 7.2 | 9.2 | 5.5×10-16 |
| Mg(OH)2 | 9.6 | 11.1 | 1.2×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
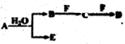 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1-2种短周期元素组成,在一定条件下有如下转化关系,请外完成下列问题:| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com