
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示: 
(1)装浓盐酸的仪器名称:;
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是; 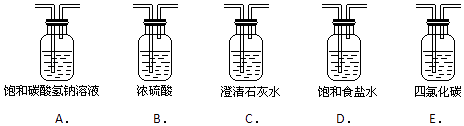
(3)如果将过量二氧化锰与20mL 12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:①;② .
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置; 
(5)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的一种溶液,有关的化学方程式是 .
【答案】
(1)分液漏斗
(2)db
(3)浓盐酸挥发;浓盐酸反应后浓度下降而与MnO2不反应
(4)I,II
(5)Cl2+2NaOH=NaCl+NaClO+H2O
【解析】解:(1)依据仪器形状装浓盐酸的仪器名称:分液漏斗;
所以答案是:分液漏斗;(2)浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性依次通过饱和食盐水、浓硫酸除去氯化氢和水蒸气;
故选:DB;(3)二氧化锰只与浓盐酸反应,反应过程中消耗氯化氢,同时浓盐酸易挥发,导致盐酸浓度降低变为稀盐酸,不再与二氧化锰反应;
所以答案是:①浓盐酸挥发;②浓盐酸反应后浓度下降而与MnO2不反应(4)氯气在饱和食盐水中溶解度不大,用排饱和食盐水法可以存贮氯气,所以装置I,II都可以用来多余的氯气;
所以答案是:I,II;(5)氯气能够与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,
所以答案是:Cl2+2NaOH=NaCl+NaClO+H2O.
【考点精析】关于本题考查的氯气的实验室制法,需要了解实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O才能得出正确答案.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某固体化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中正确的是
A. A是共价化合物 B. A是离子化合物
C. A为非电解质 D. A为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
A. 氢气的燃烧热为△H=-akJ·mol-1
B. c<d
C. 一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1
D. 0.5a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(g)十nB(g)![]() pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是

A.b1>b2 ,t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(II)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A. 任何非金属单质分子中一定含有共价键
B. 离子化合物中可能存在共价键,共价化合物中也可能存在离子键
C. 离子化合物中可能存在共价键,但共价化合物中一定不存在离子键
D. MgF2中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法不正确的是( )
A. 淀粉除做食物外,主要用来生产葡萄糖和酒精
B. 海水淡化能解决淡水供应危机,利用离子交换法可以使海水淡化
C. 正丁烷、异丁烷的沸点依次降低
D. 糖类、蛋白质、脂肪是人体必需的营养物质。它们一定条件下都能发生水解和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL 0.018mol/L![]() 溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知:
溶液中加入50mL 0.02mol/L盐酸生成沉淀。已知: ![]() ,则生成沉淀后的体系中
,则生成沉淀后的体系中![]() 为(忽略溶液体积变化)
为(忽略溶液体积变化)
A. ![]() mol/L B.
mol/L B. ![]() mol/L
mol/L
C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]目前半导体生产正在进行一场“铜芯片”革命:在硅芯片上用铜代替铝布线。古老的金属铜在现代科技应用上取得了突破。用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
![]()
(1)基态铜原子的价电子排布式为____________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是_________,其立体结构是________,与该分子互为等电子体的单质气体的化学式是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为 ;
沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为 ;
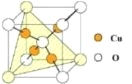
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。铜晶体中铜原子堆积模型为________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。(用含d和NA的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com