
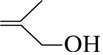
 �ķ���ʽΪC2H8O��
�ķ���ʽΪC2H8O�� �й����ŵ������ǻ����Ȼ���
�й����ŵ������ǻ����Ȼ��� ��
�� ��Ϊ����ͬ���칹�壬M�Ķ��ȴ����ͬ���칹����3�֣�
��Ϊ����ͬ���칹�壬M�Ķ��ȴ����ͬ���칹����3�֣� �����г�ǿ������ܣ�����Ϊ����ʳƷ�İ�װ���ϣ�������
�����г�ǿ������ܣ�����Ϊ����ʳƷ�İ�װ���ϣ������� ��д�ṹ��ʽ�������Ӿ۷�Ӧ���ɵģ�
��д�ṹ��ʽ�������Ӿ۷�Ӧ���ɵģ� �������Ƶ�������ͭ����Һ���ȵĻ�ѧ����ʽ��
�������Ƶ�������ͭ����Һ���ȵĻ�ѧ����ʽ�� ��
�� ���� ��1���ɽṹ��֪����ʽ��
��2���ɽṹ��ʽ��֪�������к�-OH��-COOH��
��3����Է�������Ϊ72�ҷе���͵���������$\frac{72-2}{14}$=5��֪��Ϊ���飬֧��Խ�࣬�е�Խ�ͣ�
��4��M�� ����2��Cl�����������������ڡ��ı����������ڡ����λ�ã�
����2��Cl�����������������ڡ��ı����������ڡ����λ�ã�
��5����ƫ������ϩ�� ���У�����ֻ��C����ֻ��C-C����
���У�����ֻ��C����ֻ��C-C����
��6����-CHO���л��������Ƶ�������ͭ����Һ���ȣ�����ש��ɫ����������������Ӧ��
��� �⣺��1���ɽṹ��֪����ʽΪC2H8O���ʴ�Ϊ��C2H8O��
��2���ɽṹ��ʽ��֪�������к�-OH��-COOH������Ϊ�ǻ����Ȼ����ʴ�Ϊ���ǻ����Ȼ���
��3����Է�������Ϊ72�ҷе���͵���������$\frac{72-2}{14}$=5��֪��Ϊ���飬֧��Խ�࣬�е�Խ�ͣ�����������Ϊ�����飬�ṹ��ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4��M�� ����2��Cl�����������������ڡ��ı����������ڡ����λ�ã���M�Ķ��ȴ����ͬ���칹����3�֣�
����2��Cl�����������������ڡ��ı����������ڡ����λ�ã���M�Ķ��ȴ����ͬ���칹����3�֣�
�ʴ�Ϊ��3��
��5����ƫ������ϩ�� ���У�����ֻ��C����ֻ��C-C���������
���У�����ֻ��C����ֻ��C-C��������� �����Ӿ۷�Ӧ���ɣ�
�����Ӿ۷�Ӧ���ɣ�
�ʴ�Ϊ�� ��
��
��6���춡ȩ�����Ƶ�������ͭ����Һ���ȵĻ�ѧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ���㣬�����л�������š����ʡ��л���Ӧ��ͬ���칹���ж�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�⣨4��Ϊ�����ѵ㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ag��NH3��2NO3��Һ�м������Ag��NH3��2++2H+=Ag++2NH4+ | |
| B�� | ������������Fe3O4����������Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C�� | ���Ȼ�����Һ�м��������ˮ��Al3++4OH-=AlO2-+2H2O | |
| D�� | ��Ca��HCO3��2��Һ�м������ʯ��ˮ��Ca2++HCO3-+OH-=CaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | I2���� | B�� | NaCl���������� | C�� | HCl����ˮ | D�� | NH4HCO3���ȷֽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3N4������ÿ��Cԭ������4��Nԭ�ӣ���ÿ��Nԭ������3��Cԭ�� | |
| B�� | C3N4������C-N�����Ƚ��ʯ��C-CҪ�� | |
| C�� | C3N4������������ܴ������ | |
| D�� | C3N4�����Ƿ��Ӿ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H4��C4H8 | B�� | ����ͱ�ϩ�� | ||
| C�� |  �� �� | D�� | ���Ǻ���ѿ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�鷽�� |  |  |  |  |
| Ŀ�� | A���Ƚ��Ҵ��������ǻ���ԭ�Ӻ�ˮ��������ԭ�ӵĻ����� | B����ȥ��ϩ�еĶ������� | C����������Һ | D��֤��̼������ǿ�ڱ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol/L��ˮ��pHΪ11��NH3•H2O?NH4++OH- | |
| B�� | ��NaCl��Һ������������ʴʵ�飬O2���٣�2H2O+O2+4e-=4OH- | |
| C�� | ��H2��O2��������ȼ�ϵ��ʵ�飬����������2H2+O2$\stackrel{��ȼ}{��}$2H2O | |
| D�� | ��NH4Cl��Һ�ܽ�Mg��OH��2�������ܽ⣺Mg��OH��2+2NH4++2NH3•H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe��OH��3 | Cd��OH��2 | Zn��OH��2 |
| ��ʼ������pH | 1.5 | 7.2 | 5.9 |
| ������ȫ��pH | 3.3 | 9.9 | 8.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ������ | T/K | ����ʯ��� | HNO3Ũ��mol/L | ʵ��Ŀ�� |
| �� | 298 | �ֿ��� | 2.00 | ʵ��ٺ͢�̽��HNO3 Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ��II��ʵ��ٺ�____̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ��III��ʵ��ٺ�____̽������ʯ��֡�ϸ���Ը÷�Ӧ���ʵ�Ӱ�죮 |
| �� | 298 | �ֿ��� | 1.00 | |
| �� | 308 | �ֿ��� | 2.00 | |
| �� | 298 | ϸ���� | 2.00 |

 �˿�ɾȥ��
�˿�ɾȥ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com