
【题目】已知A、B、C、D、E、F都是周期表中前四周期元素,它们的核电荷数A。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题: (答题时用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为________________________。
(2)将以下三种物质①B的氯化物②D的氯化物③A、C形成的一种具有高硬度、耐磨新型无机非金属材料,按熔点由高到低的顺序排列__________________(用序号排列表示)。
(3)A的最高价氧化物对应的水化物分子中,其中心原子采取_____杂化,E的最高价氧化物分子的空间构型是___________________。
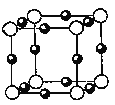
(4)F的基态原子的核外电子排布式是_______________,A、F形成某种化合物的晶胞结构如下图所示,则其化学式为____________,A、F配位数依次为______、________。(黑球为F,白球为A)
【答案】 Na<Al<Si<N ③①② sp2 平面正三角形 ls22s22p63s23p63d104s1 (或[Ar]3d104s1) Cu3N 6 2
【解析】A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1s22s22p3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为ls22s22p63s23p63d104s1,故F为Cu元素。
(1)在元素周期表中,同一周期元素的第一电离能从左到右呈增大趋势,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N,故答案:Na<Al<Si<N;
(2)①B的氯化物为氯化钠,为离子晶体,②D的氯化物为SiCl4,为分子晶体③A、C形成的物质具有高硬度、耐磨特性,属于原子晶体,则熔点由高到低的顺序为③①②,故答案为:③①②;
(3)A的最高价酸根离子NO3-,中心N原子价层电子对数为3+![]() =3,则N原子采取sp2杂化;E的最高价氧化物为SO3,S原子孤电子对数为
=3,则N原子采取sp2杂化;E的最高价氧化物为SO3,S原子孤电子对数为![]() =0,价层电子对数为3+0=3,则为平面三角形结构,故答案为:sp2;平面三角形;
=0,价层电子对数为3+0=3,则为平面三角形结构,故答案为:sp2;平面三角形;
(4)F为Cu元素,其核外电子排布式为:1s22s22p63s23p63d104s1(或[Ar]3d104s1),F为Cu,A为N,且N为-3价,由晶胞结构图可知,N原子在顶点,则N原子数为8×![]() =1,Cu原子在棱心,则Cu原子数为12×
=1,Cu原子在棱心,则Cu原子数为12×![]() =3,所以化学式为Cu3N;根据图示,Cu原子位于棱上,N原子在顶点,每个Cu原子周围有2个N原子,每个N原子周围有6个铜原子,N、Cu的配位数依次为6、2,故答案为:ls22s22p63s23p63d104s1 (或[Ar]3d104s1);Cu3N;6;2。
=3,所以化学式为Cu3N;根据图示,Cu原子位于棱上,N原子在顶点,每个Cu原子周围有2个N原子,每个N原子周围有6个铜原子,N、Cu的配位数依次为6、2,故答案为:ls22s22p63s23p63d104s1 (或[Ar]3d104s1);Cu3N;6;2。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】分类法是学习和研究化学物质的一种常用科学方法.下列“链状连环”图案中,相连的两种物质均可归属为一类,相交部分A、B、C、D为其分类依据代号.请回答: ![]()
(1)请将A、B、C、D填入相应的横线内.
①两种物质都是氧化物
②两种物质都是盐
③两种物质都不是电解质
(2)用洁净的烧杯取25mL蒸馏水,加热至沸腾,逐滴加入上图中一种物质的饱和溶液5~6滴,继续加热,制得红褐色的胶体.
①以上反应的化学方程式为 .
②简述胶体制取成功的判断依据是 .
③向该胶体中逐滴加入稀硫酸,观察到:
A.先出现红褐色沉淀,说明胶体发生 .
B.随后红褐色沉淀溶解,反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机物在一定条件下不能作为合成高分子化合物单体的是
A.丙烯酸B.丙酸 CH3CH2COOH
C.甘氨酸 NH2CH2COOHD.乳酸 CH3CH(OH)COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,能说明化学平衡一定向逆反应方向移动的是
A. N2O4(g)![]() 2NO2(g),改变某一条件后,气体颜色变浅
2NO2(g),改变某一条件后,气体颜色变浅
B. N2(g)+3H2(g)![]() 2NH3(g),改变某一条件后,NH3的体积分数减少
2NH3(g),改变某一条件后,NH3的体积分数减少
C. H2(g)+I2(g)![]() 2HI(g),单位时间内消耗H2和HI的物质的量之比等于1∶2
2HI(g),单位时间内消耗H2和HI的物质的量之比等于1∶2
D. 2SO2(g)+O2(g)![]() 2SO3(g),恒温恒压条件下,充入He
2SO3(g),恒温恒压条件下,充入He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和生活中有重要的应用,下列说法不正确的是
A. 小苏打在生活中可用做发酵粉 B. 过氧化钠可用于呼吸面具中氧气的来源
C. 可溶性铁盐或铝盐可用于净水 D. 碳酸钠常用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是
A.称量时,左盘高,右盘低
B.定容后,轻轻振荡、摇匀、静置,液面下降再加水至刻度
C.容量瓶使用前未干燥
D.定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的钠、镁、铝与过量的稀硫酸反应,在标况下产生氢气的体积比是( )
A. 1:1:1 B. 1:2:3 C. 6:3:2 D. 23:24:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对应反应的方程式不正确的是( )
A. 测0.1molL-1氨水的pH为11:NH3H2O![]() NH4++OH-
NH4++OH-
B. 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑
C. 用CuCl2溶液做导电实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
D. Fe2O3溶于HI溶液中:Fe2O3 + 6H+ +2I-=2Fe3++ 3H2O+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子因发生水解反应而不能大量共存的是
A. Ba2+、Cl-、Na+、SO42- B. Al3+、K+、HCO3-、Cl-
C. H+、Fe2+、SO42-、NO3- D. AlO2-、Na+、Cl-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com