

分析 用含有Fe2O3 的钛铁矿(主要成分为FeTiO3 )为原料制备二氧化钛:钛铁矿溶于酸生成亚铁离子和TiO2+,反应的离子方程式为:FeTiO3+4H+=Fe2++TiO2++2H2O,步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,步骤③利用的是物质溶解度的不同,通过冷却热饱和溶液,冷却结晶得到硫酸亚铁晶体,④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2.
(1)碱性氧化物和酸反应生成盐和水;
(2)金属铁可以和铁离子反应生成亚铁离子,结合电荷守恒、原子守恒配平写出离子方程式;根据物质溶解度分析析出晶体的条件应用;
(3)TiO2+发生水解生成钛酸(H2TiO3)沉淀,根据元素守恒写出反应的离子方程式;
(4)依据二氧化锰的氧化性氧化亚铁离子分析氧化还原反应生成二价锰的化合物,结合电荷守恒和原子守恒写出;
(5)依据图示生成物质的分析,阳极生成二氧化碳,阴极析出钙,结合电解池中阳极发生氧化反应,阴极发生还原反应,写出电极反应;根据电解槽中发生的反应:2CaO$\frac{\underline{\;电解\;}}{\;}$2Ca+O2↑以及钙还原二氧化钛反应方程式:2Ca+TiO2=Ti+2CaO来回答;
(6)根据钛原子守恒进行解答.
解答 解:(1)氧化铁和硫酸反应生成硫酸铁和水,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)用铁粉将Fe3+转化为Fe2+的反应的离子方程式为:2Fe3++Fe=3Fe2+,步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到,
故答案为:2Fe3++Fe=3Fe2+;b;
(3)TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+,
故答案为:TiO2++2H2O═H2TiO3↓+2H+;
(4)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),利用二氧化锰的氧化性氧化亚铁离子为三价铁离子,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(5)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑;
②阴极上电极反应式为:2Ca2++4e-═2Ca,阳极上电极反应为:2O2--4e-=O2↑,电解槽中发生反应:2CaO$\frac{\underline{\;电解\;}}{\;}$2Ca+O2↑,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变;
(6)如果取钛铁矿4t,生产出1.6吨的二氧化钛,其中钛元素的质量是1.6×$\frac{48}{80}$×100%=0.96t,所以钛铁矿中钛的质量分数$\frac{0.96}{4}$×100%=24%,
故答案为:24%.
点评 本题考查了二氧化钛的制备,考查了物质分离的流程分析判断,物质性质的应用,离子性质的应用,分离操作的方法,氧化还原反应的离子方程式的书写方法,电解池原理的应用,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铜晶体的堆积方式为面心立方最密堆积 | |
| B. | H2O很稳定是因为水中有氢键 | |
| C. | 氯化钠熔化破坏了离子键 | |
| D. | 12g金刚石中含有的碳碳键数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L | B. | 22.4L | C. | 33.6L | D. | 44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
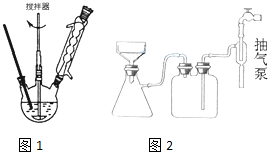 羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:

| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
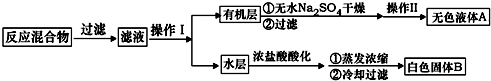
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
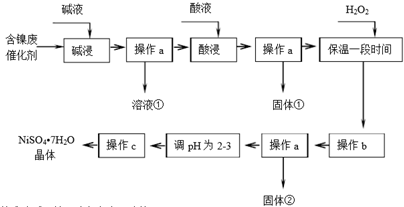
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com