
下列有关实验操作或测量数据合理的是 (填写序号)
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
d.实验室酸制氯化亚锡溶液时,可以先将氯化亚锡溶解在盐酸中,再配制到所需要的浓度
e.使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤干净
f.在用稀硫酸和锌粒反应制取氢气时加入少许硫酸铜以加快化学反应速率
科目:高中化学 来源: 题型:
 熟悉实验仪器,能正确进行实验操作是做好化学实验的前提.
熟悉实验仪器,能正确进行实验操作是做好化学实验的前提.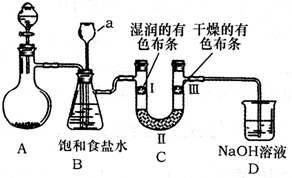
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下列有关实验操作或结果的说法中正确的是 (填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10 mol·L-1的KMnO4溶液15.10 mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
F.用广泛pH试纸测量H2SO4溶液的pH时,测得pH=3.2
G.测定酸碱滴定曲线:开始时测试和记录的间隔可稍小些,滴定至终点附近则要大些
Ⅱ.(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式 。已知H2O(l) = H2O(g) ΔH =+44 kJ·mol-1 则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷P4和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198 kJ·mol-1 P-O 360 kJ·mol-1,氧气分子内氧原子间的(O=O)键能为498kJ·mol-1。则P4+3O2= P4O6的反应热ΔH为 。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年广东省梅州市曾宪梓中学高二上学期期末考试理综)化学部分 题型:填空题
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三1月月考化学试卷(解析版) 题型:实验题
熟悉实验仪器,能正确进行实验操作是做好化学实验的前提。
(1)下列有关实验操作或实验事实的叙述,正确的是 (填序号)。
A.实验室中浓硝酸应保存在棕色细口瓶中,并贴有如图所示标签

B.用50mL量筒量取5.6mL浓硫酸
C.中和滴定实验时,锥形瓶洗涤干净并用标准液润洗后,方可注入待测液
D.用四氯化碳萃取碘水中的碘,分液时有机层从分液漏斗的下端放出
E.用广泛pH试纸测得某溶液的pH为4.8
(2)下图是实验室制备氯气并探究氯气是否具有漂白性的实验装置(夹持及加热仪器已省略)。
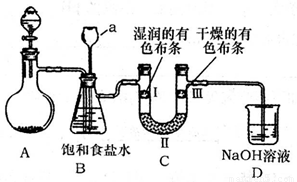
①A装置中反应的化学方程式为 。
②B装置中仪器a的名称是 。
③B装置的作用是除去气体中混有的HCl,兼起安全瓶的作用,当仪器a中液面不
断上升时,说明 ,此时应停止实验。
④实验中观察到 ,说明干燥氯气无漂白性。
查看答案和解析>>
科目:高中化学 来源:2012届广东省梅州市高二上学期期末考试理综)化学部分 题型:填空题
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com