
 .
.
 ,则氨气的平衡转化率是75%.
,则氨气的平衡转化率是75%.
分析 (1)AsH3中As原子与H原子之间形成1对共用电子对;
(2)次氯酸钠与氨气反应生成N2H4,反应中N元素化合价升高,NH3为还原剂,则NaClO为氧化剂,反应中还原剂与氧化剂的物质的量之比为2:1,设Cl元素在还原产物中化合价为a,则2×[(-2)-(-3)]=1×(1-a),解得a=-1,故还原生成NaCl,由元素守恒可知有水生成;
(3)由图象可知,As2O5分解为As2O3需要吸收的热量,1molAs2O5分解的焓变△H=-619.2kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,注明物质的聚集状态与反应热书写热化学方程式;
(4)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水;
(5)由图可知,开始时氨气体积分数为50%,则开始氨气与二氧化碳的物质的量相等,设氨气、二氧化碳均为1mol,设转化的氨气为xmol,由方程式可知平衡时混合气体减少物质的量等于氨气物质的量,再根据平衡氨气的体积分数为20%列方程计算解答;
(6)学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(7)a.随反应进行混合气体物质的量减小,容器内气体压强减小,压强保持不变说明到达平衡;
b.在t2时,正逆反应速率都增大,且平衡正向移动,结合正反应为氢气体积减小的吸热反应分析解答;
c.混合气体总质量不变,容器容积不变,混合气体的密度始终不变;
d.t2时平衡正向移动,t4时减小了生成物浓度,平衡正向移动,反应物浓度相应减小,容器内NO2的体积分数在t3~t4时最大.
解答 解:(1)AsH3中As原子与H原子之间形成1对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(2)次氯酸钠与氨气反应生成N2H4,反应中N元素化合价升高,NH3为还原剂,则NaClO为氧化剂,反应中还原剂与氧化剂的物质的量之比为2:1,设Cl元素在还原产物中化合价为a,则2×[(-2)-(-3)]=1×(1-a),解得a=-1,故还原生成NaCl,由元素守恒可知有水生成,反应方程式为NaClO+2NH3=N2H4+NaCl+H2O,
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(3)由图象可知,As2O5分解为As2O3需要吸收的热量,1molAs2O5分解的焓变△H=-619.2kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(4)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
(5)由图可知,开始时氨气体积分数为50%,则开始氨气与二氧化碳的物质的量相等,设氨气、二氧化碳均为1mol,设转化的氨气为xmol,由方程式CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O可知,平衡时混合气体减少物质的量等于氨气物质的量,故平衡时混合气体总物质的量为(2-x)mol,平衡时氨气为(1-x)mol,则$\frac{(1-x)mol}{(2-x)mol}$=20%,解得x=0.75,故氨气转化率为$\frac{0.75mol}{1mol}$×100%=75%,
故答案为:75%;
(6)可逆反应NH2COONH4(s)?2NH3(g)+CO2(g)的化学平衡常数的表达式K=c2(NH3)•c(CO2),故答案为:K=c2(NH3)•c(CO2);
(7)a.2NO(g)+O2(g)?2NO2(g)该反应是气体体积减小的反应,随反应进行混合气体物质的量减小,容器内气体压强减小,容器内气体的压强保持不变,说反应已达到平衡状态,故a正确;
b.在t2时,正逆反应速率都增大,且平衡正向移动,由于正反应为氢气体积减小的吸热反应,可能是升高温度,或增大压强,故b正确;
c.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故c错误;
d.t2时平衡正向移动,t4时减小了生成物浓度,平衡正向移动,反应物浓度相应减小,所以容器内NO2的体积分数在t3~t4时最大,故d错误,
故选:ab.
点评 题目比较综合,属于拼合型题目,涉及化学平衡计算与影响因素、平衡图象、平衡常数、原电池、热化学方程式书写、氧化还原反应、电子式等,是对学生综合能力的考查,需要学生具备扎实的基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CCl4比水轻 | |
| B. | CCl4与水和I2均不反应 | |
| C. | CCl4与原溶剂水互不相溶 | |
| D. | I2在CCl4中的溶解度比在水中大得多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
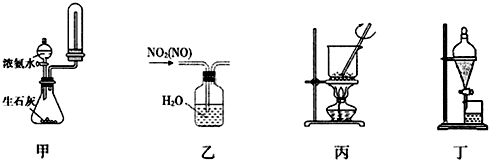
| A. | 用装置甲制取并收集干燥纯净的NH3 | |
| B. | 用装置乙除去NO2中混有的少量NO | |
| C. | 用装置丙将氢氧化钠固体加热熔融 | |
| D. | 用装置丁把溴水中的溴萃取分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 溶液 | B. | NaOH溶液 | C. | Ba(OH)2溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 摩尔质量为313.5 g | B. | 属于芳香烃 | ||
| C. | 分子式为C12H19Cl3N2O | D. | 不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  硫磺 | B. |  高锰酸钾 | C. |  氢气 | D. |  乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com