
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为_____________。
(2)反应前A的物质的量浓度是_________。
(3)10 s末,生成物D的浓度为________。
(4)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;②增大A的浓度_____;③恒容下充入氖气________。
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________。
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
(6)将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)NH3(g)+HI(g),2HI(g)H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L1,c(HI)=4mol·L1,则NH3的浓度为_______________。
【答案】0.04mol/(Ls) 1.5mol/L 0.4mol/L 减小 增大 不变 C 5mol·L1
【解析】
(1)由题可知,10s内,C的物质的量增加了0.8mol,容器的容积为2L,所以用C表示的反应速率为:![]() ;
;
(2)由题可知,平衡时A的物质的量为1.8mol,且容器中C的物质的量为0.8mol;又因为发生的反应方程式为:![]() ,所以反应过程中消耗的A为1.2mol,那么初始的A为3mol,浓度即1.5mol/L;
,所以反应过程中消耗的A为1.2mol,那么初始的A为3mol,浓度即1.5mol/L;
(3)由于初始时,只向容器中加入了A和B,且平衡时生成的C的物质的量为0.8mol,又因为C和D的化学计量系数相同,所以生成的D也是0.8mol,那么浓度即为0.4mol/L;
(4)①降低温度会使反应速率下降,所以生成D的速率减小;
②增大A的浓度会使反应速率增大,生成D的速率增大;
③恒容条件充入惰性气体,与反应有关的各组分浓度不变,反应速率不变,因此生成D的速率也不变;
(5)A.由选项中给出的关系并不能推出正逆反应速率相等的关系,因此无法证明反应处于平衡状态,A项错误;
B.该反应的气体的总量保持不变,由公式![]() ,恒温恒容条件下,容器内的压强恒定与是否平衡无关,B项错误;
,恒温恒容条件下,容器内的压强恒定与是否平衡无关,B项错误;
C.A的体积分数不变,即浓度不再变化,说明该反应一定处于平衡状态,C项正确;
D.根据公式:![]() ,容器内气体的总质量恒定,总体积也恒定,所以密度为定值,与是否平衡无关,D项错误;
,容器内气体的总质量恒定,总体积也恒定,所以密度为定值,与是否平衡无关,D项错误;
E.消耗B和生成D的过程都是正反应的过程,由选项中的条件并不能证明正逆反应速率相等,所以不一定平衡,E项错误;
答案选C;
(6)由题可知,NH4I分解产生等量的HI和NH3;HI分解又会产生H2和I2;由于此时容器内c(H2)=0.5mol/L,说明HI分解生成H2时消耗的浓度为0.5mol/L×2=1mol/L,又因为容器内c(HI)=4mol/L,所以生成的HI的总浓度为5mol/L,那么容器内NH3的浓度为5mol/L。


科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
Ⅰ.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则N2(g)+3H2(g)=2NH3(g) ΔH=______________
Ⅱ.下图是镁铝原电池请写出甲的电池总反应______________ ,乙池铝极的电极反应式______________

Ⅲ.下图是一个化学过程的示意图,回答下列问题:

(1)乙装置中电极A的名称是__________
(2)甲装置中通入CH4的电极反应式为 ________________________________________________
(3)一段时间,当丙池中产生224 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为1000 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A.装置中存在“化学能→电能→光能”的转化
B.锌片上发生的电极反应为![]()
C.如果将稀硫酸换成柠檬汁,则导线中不会有电子流动
D.如果将锌片换成铁片,则电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解,阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

(1)电解饱和食盐水的化学方程式为______;
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是_________(填字母序号)。
a.Na2SO4b.Na2SO3 c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3-,IO3-可继续被氧化为高碘酸根(IO4-),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度判断ICl中碘元素的化合价应为________。
②NaIO3被氧化为NaIO4的离子方程式为_________;
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如图所示。已知:吸光度越高表明该体系中c(I2)越大。

用离子方程式解释10min时不同pH体系吸光度不同的原因:______;
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:______;
③研究表明食盐水中I-含量≤0.2mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mgL-1的食盐水进行处理,为达到使用标准,理论上至少需要0.05molL-1NaClO溶液___L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示![]() 已知A、B、C均为气体
已知A、B、C均为气体![]() 。
。

(1)该反应的化学方程式为_______________。
(2)反应开始至2分钟时,B的平均反应速率为_______________。
(3)能说明该反应已达到平衡状态的是_______________。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360s | 480s | 540s | 720s |
MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
①该研究小组在设计方案时。考虑了浓度、_______________、_______________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________。
(6)将质量相同但聚集状态不同的![]() 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
催化剂 | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出![]() 发生分解的化学反应方程式_______________。
发生分解的化学反应方程式_______________。
②实验结果说明催化剂作用的大小与_______________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是 ClO3-和 Cl-,在 75℃以上、浓碱溶液中主要产物是ClO-和 Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
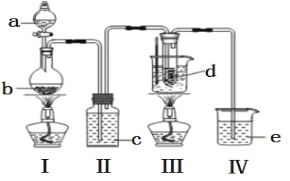
a 为浓盐酸,b 为MnO2,c 为饱和食盐水, d 为 30%KOH 溶液,e 为 NaOH 溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置 III 水温升至 75℃开始反应。
①装置 II 的作用为_____________________________________。
②若取消装置 II,对本实验的影响是___________________。
③从装置 III 的试管中分离得到 KClO3 粗产品,其中混有的杂质是 KClO 和_____________(填化学式)。
(2)为测定产品 KClO3 的纯度,进行如下实验:
步骤 1:取 3.00g 样品溶于水配成 250mL 溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,滴加足量H2O2 溶液充分振荡以除尽ClO-。然后煮沸溶液 1~2 分钟,冷却。
步骤 3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3- +6I- +6H+= Cl-+3I2+3H2O)
步骤 4:加入指示剂,用 0.600mol/LNa2S2O3 标准溶液滴定至终点,消耗标准溶液 20.00mL。(2S2O32-+I2=S4O62-+2I-)
步骤 2 中除去 ClO-的离子方程式是_________________。
②样品中 KClO3 的貭量分数为_____。(保留三位有效数字,KClO3 式量:122.5)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com