
| A、5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA |
| B、标况下,22.4L SO3含有NA个SO3分子 |
| C、78g Na2O2与足量水充分反应时电子转移数为2NA |
| D、4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
| m |
| M |
| m |
| M |
| m |
| M |
| 54g |
| 13g/mol |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
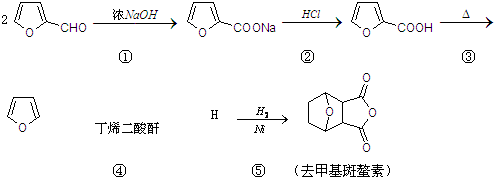
 (Diels-Alder 反应).
(Diels-Alder 反应).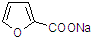 外,还生成另一产物,此物质的结构简式为
外,还生成另一产物,此物质的结构简式为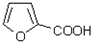 制备化合物丁烯二酸酐
制备化合物丁烯二酸酐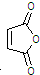 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:| 浓硫酸 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ |
| Ⅱ |
| 氮的固定 |
| ||
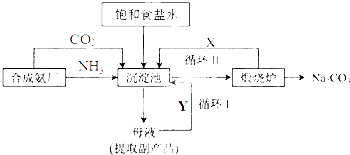
查看答案和解析>>
科目:高中化学 来源: 题型:
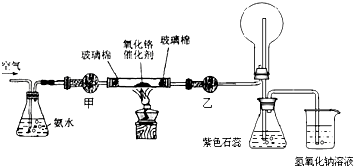
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如查看答案和解析>>
科目:高中化学 来源: 题型:
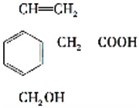 ,这种有机物不可能具有的性质是( )
,这种有机物不可能具有的性质是( )| A、既能发生取代反应,也能发生加成反应和水解反应 |
| B、分子中所有碳原子可能共面,所有原子不可能共面 |
| C、能跟NaOH溶液反应,也能跟Na2CO3溶液反应 |
| D、标准状况下,22.4L该有机物与足量的Na反应,生成氢气的质量大于2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com