
”¾ĢāÄæ”涞ĀČ»ÆĮņ(SCl2)ČŪµć-78”ę£¬·Šµć59”ę£¬ĆܶČ1.638g/mL£¬ÓöĖ®Ņ×·Ö½ā£¬¶žĀČ»ÆĮņÓėČżŃõ»ÆĮņ×÷ÓĆæÉÉś³ÉÖŲŅŖ»Æ¹¤ŹŌ¼ĮŃĒĮņõ£ĀČ(SOCl2)”£ŅŌĻĀŹĒĀČĘųÓėĮņŗĻ³É¶žĀČ»ÆĮņµÄŹµŃé×°ÖĆ”£
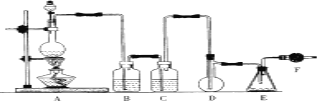
ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)×°ÖĆAÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______________________”£
(2)×°ÖĆBÓ¦Ź¢·ÅµÄŅ©Ę·ŹĒ__________£¬CÖŠŹĒ______________”£
(3)ŹµŃ鏱£¬D×°ÖĆŠč¼ÓČČÖĮ50”Ŗ59”ę£®×īŗĆ²ÉÓĆ_____________·½Ź½¼ÓČČ”£
(4)ŌŚÅäÖĘŅ»¶ØĪļÖŹµÄĮæÅØ¶ČµÄŃĪĖįČÜŅŗŹ±£¬ĻĀĮŠ²Ł×÷ĖłÅäČÜŅŗÅضČĘ«µĶµÄŹĒ__________£»
A.ÅäÖĘČÜŅŗŹ±£¬ČŻĮæĘæÖŠÓŠÉŁĮæĖ®”£
B.Ź¹ÓĆČŻĮæĘæÅäÖĘČÜŅŗŹ±,ø©ŹÓ¹Ū²ģČÜŅŗ°¼ŅŗĆęÓėČŻĮæĘææĢ¶ČĻßĻąĒŠ
C.ÅäÖĘČÜŅŗµÄ¹ż³ĢÖŠ£¬ČŻĮæĘæĪ“ČūŗĆ£¬Č÷³öŅ»Š©ČÜŅŗ”£
D.·¢ĻÖČÜŅŗŅŗĆę³¬¹żæĢ¶ČĻߣ¬ÓĆĪü¹ÜĪü³öÉŁĮæĖ®£¬Ź¹ŅŗĆę½µÖĮæĢ¶ČĻß
”¾“š°ø”æMnO2+4HCl(ÅØ) ![]() MnCl2+Cl2”ü+2H2O ±„ŗĶŹ³ŃĪĖ®(»ņĖ®) ÅØĮņĖį Ė®Ō” CD
MnCl2+Cl2”ü+2H2O ±„ŗĶŹ³ŃĪĖ®(»ņĖ®) ÅØĮņĖį Ė®Ō” CD
”¾½āĪö”æ
ŌŚ×°ÖĆAÖŠÖʱøĀČĘų£¬B”¢CÓĆÓŚ³żŌÓ£¬·Ö±š³żČ„ĀČ»ÆĒāŗĶĖ®£¬ŹµŃéæŖŹ¼Ē°ĻČŌŚDÖŠ·ÅČėŅ»¶ØĮæµÄĮņ·Ū£¬¼ÓČČŹ¹ĮņČŪ»Æ£¬Č»ŗó×Ŗ¶ÆŗĶŅ”¶ÆÉÕĘæŹ¹Įņø½×ÅŌŚÉÕĘæÄŚ±Ś±ķĆęŠĪ³ÉŅ»±”²ć£¬æÉŌö“óĮņÓėĀČĘųµÄ½Ó“„Ć껿£¬ĄūÓŚ³ä·Ö·“Ó¦£¬Ņņ¶žĀČ»ÆĮņÓöĖ®Ņ×·Ö½ā£¬FÓĆÓŚ·ĄÖ¹æÕĘųÖŠµÄĖ®ÕōĘų½ųČė×°ÖĆ£¬²¢ĪüŹÕĀČĘų·ĄÖ¹ĪŪČ¾»·¾³£¬ŅŌ“Ė½ā“šøĆĢā”£
(1)ŹµŃéŹŅÓĆÅØŃĪĖįÓė¶žŃõ»ÆĆĢ¼ÓČČÖʱøĀČĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖMnO2+4HCl(ÅØ) ![]() MnCl2+Cl2”ü+2H2O£»
MnCl2+Cl2”ü+2H2O£»
(2)ŹµŃéŹŅÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖįÖĘČ”ĀČĘų£¬ÅØŃĪĖįŅ×»Ó·¢£¬ĖłŅŌÖʵƵÄĀČĘų²»“棬»ģÓŠĀČ»ÆĒāŗĶĖ®£¬ĻČÓĆŹ¢ÓŠ±„ŗĶŹ³ŃĪĖ®µÄB×°ÖĆ³żČ„ĀČ»ÆĒā£¬ŌŁÓĆŹ¢ÓŠÅØĮņĖįµÄC×°ÖĆĪüĖ®£»
(3)ŹµŃ鏱£¬D×°ÖĆŠč¼ÓČČÖĮ50-59”ę½éÓŚĖ®Ō”ĪĀ¶Č0-100”ę£¬Ņņ“Ė²ÉÓĆµÄ¼ÓČČ·½Ź½ĪŖĖ®Ō”¼ÓČČ£»
(4)½įŗĻc=n/V·ÖĪöŃ”Ļī£¬
A.ÅäÖĘČÜŅŗŹ±£¬ČŻĮæĘæÖŠÓŠÉŁĮæĖ®£¬¶ŌĖłÅäČÜŅŗÅضČƻӊӰĻģ£»
B.Ź¹ÓĆČŻĮæĘæÅäÖĘČÜŅŗŹ±£¬ø©ŹÓ¹Ū²ģČÜŅŗ°¼ŅŗĆęÓėČŻĮæĘææĢ¶ČĻßĻąĒŠ£¬Ź¹µĆČÜŅŗµÄĢå»żĘ«Š”£¬ŌņĖłµĆČÜŅŗÅضČĘ«øߣ»
C.ÅäÖĘČÜŅŗµÄ¹ż³ĢÖŠ£¬ČŻĮæĘæĪ“ČūŗĆ£¬Č÷³öŅ»Š©ČÜŅŗ£¬ĖłÅäČÜŅŗÅضČĘ«µĶ£»
D.·¢ĻÖČÜŅŗŅŗĆę³¬¹żæĢ¶ČĻߣ¬ÓĆĪü¹ÜĪü³öÉŁĮæĖ®£¬Ź¹ŅŗĆę½µÖĮæĢ¶Č£¬ĖłµĆČÜŅŗÅضČĘ«µĶ£¬
¹ŹŗĻĄķŃ”ĻīŹĒCD”£


 Č«ÓŵćĮ·µ„ŌŖ¼Ę»®ĻµĮŠ“š°ø
Č«ÓŵćĮ·µ„ŌŖ¼Ę»®ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ![]() ŗĶ
ŗĶ![]() ŹĒĮ½ÖÖÖ÷ŅŖµÄĪĀŹŅĘųĢ壬ŅŌ
ŹĒĮ½ÖÖÖ÷ŅŖµÄĪĀŹŅĘųĢ壬ŅŌ![]() ŗĶ
ŗĶ![]() ĪŖŌĮĻÖĘŌģøüøß¼ŪÖµµÄ»Æѧ²śĘ·ŹĒÓĆĄ“»ŗ½āĪĀŹŅŠ§Ó¦µÄŃŠ¾æ·½Ļņ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
ĪŖŌĮĻÖĘŌģøüøß¼ŪÖµµÄ»Æѧ²śĘ·ŹĒÓĆĄ“»ŗ½āĪĀŹŅŠ§Ó¦µÄŃŠ¾æ·½Ļņ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¹¤ŅµÉĻ![]() “ß»ÆÖŲÕūŹĒÄæĒ°“ó¹ęÄ£ÖĘČ”ŗĻ³ÉĘų£ØCOŗĶH2»ģŗĻĘų³ĘĪŖŗĻ³ÉĘų£©µÄÖŲŅŖ·½·Ø£¬ĘäŌĄķĪŖ£ŗ
“ß»ÆÖŲÕūŹĒÄæĒ°“ó¹ęÄ£ÖĘČ”ŗĻ³ÉĘų£ØCOŗĶH2»ģŗĻĘų³ĘĪŖŗĻ³ÉĘų£©µÄÖŲŅŖ·½·Ø£¬ĘäŌĄķĪŖ£ŗ
·“Ó¦¢ń£ŗ![]() £»
£»![]()
·“Ó¦¢ņ£ŗ![]() £»
£»![]()
![]() ŗĶ
ŗĶ![]() ·“Ӧɜ³É
·“Ӧɜ³É![]() ŗĶ
ŗĶ![]() µÄČČ»Æѧ·½³ĢŹ½ŹĒ___________________”£
µÄČČ»Æѧ·½³ĢŹ½ŹĒ___________________”£
(2)½«1 mol ![]() ŗĶ1 mol
ŗĶ1 mol ![]() ¼ÓČėŗćĪĀŗćŃ¹µÄĆܱÕČŻĘ÷ÖŠ£ØĪĀ¶Č298K”¢Ń¹Ēæ100kPa£©£¬·¢Éś·“Ó¦¢ń£¬²»æ¼ĀĒ·“Ó¦¢ņµÄ·¢Éś£¬øĆ·“Ó¦ÖŠ£¬Õż·“Ó¦ĖŁĀŹ
¼ÓČėŗćĪĀŗćŃ¹µÄĆܱÕČŻĘ÷ÖŠ£ØĪĀ¶Č298K”¢Ń¹Ēæ100kPa£©£¬·¢Éś·“Ó¦¢ń£¬²»æ¼ĀĒ·“Ó¦¢ņµÄ·¢Éś£¬øĆ·“Ó¦ÖŠ£¬Õż·“Ó¦ĖŁĀŹ![]() £¬pĪŖ·ÖŃ¹£Ø·ÖŃ¹=×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż£©£¬ČōøĆĢõ¼žĻĀ
£¬pĪŖ·ÖŃ¹£Ø·ÖŃ¹=×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż£©£¬ČōøĆĢõ¼žĻĀ![]() £¬µ±
£¬µ±![]() ·Ö½ā20%Ź±£¬
·Ö½ā20%Ź±£¬![]() __________kPas-1”£
__________kPas-1ӣ
(3)½«![]() ŗĶ
ŗĶ![]() ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æÉÖʵĆŗĻ³ÉĘų£¬ŌŚ1 LĆܱÕČŻĘ÷ÖŠĶØČė
ŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦æÉÖʵĆŗĻ³ÉĘų£¬ŌŚ1 LĆܱÕČŻĘ÷ÖŠĶØČė![]() Óė
Óė![]() £¬Ź¹ĘäĪļÖŹµÄĮæÅØ¶Č¾łĪŖ
£¬Ź¹ĘäĪļÖŹµÄĮæÅØ¶Č¾łĪŖ![]() £¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ
£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗ£¬²āµĆCH4µÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č¼°Ń¹ĒæµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£ŗ
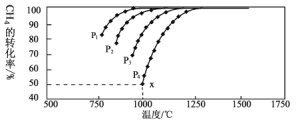
¢ŁŃ¹Ēæ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() ÓÉŠ”µ½“óµÄ¹ŲĻµĪŖ_________”£
ÓÉŠ”µ½“óµÄ¹ŲĻµĪŖ_________”£
¢Ś¶ŌÓŚĘųĻą·“Ó¦£¬ÓĆij×é·Ö£ØB£©µÄĘ½ŗāŃ¹Ēæp(B)“śĢęĪļÖŹµÄĮæÅضČc(B)Ņ²æɱķŹ¾Ę½ŗā³£Źż£Ø¼Ē×÷![]() £©£¬Čē¹ū
£©£¬Čē¹ū![]() £¬ĒóxµćµÄĘ½ŗā³£Źż
£¬ĒóxµćµÄĘ½ŗā³£Źż![]() ________________£ØÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£©”£
________________£ØÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£©”£
¢ŪĻĀĮŠ“ėŹ©ÖŠÄÜŹ¹Ę½ŗāÕżĻņŅĘ¶ÆµÄŹĒ___________£ØĢī×ÖÄø£©”£
a£®ÉżøßĪĀ¶Č
b£®Ōö“óŃ¹Ēæ
c£®±£³ÖĪĀ¶Č”¢Ń¹Ēæ²»±ä£¬³äČėHe
d£®ŗćĪĀ”¢ŗćČŻ£¬ŌŁ³äČė1 mol ![]() ŗĶ1 mol
ŗĶ1 mol ![]()
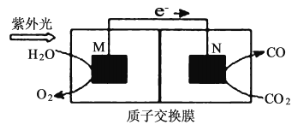
(4)æĘѧ¼Ņ»¹ŃŠ¾æĮĖĘäĖū×Ŗ»ÆĪĀŹŅĘųĢåµÄ·½·Ø£¬ĄūÓĆĶ¼ĖłŹ¾×°ÖĆæÉŅŌ½«![]() ×Ŗ»ÆĪŖĘųĢåČ¼ĮĻCO£Øµē½āÖŹČÜŅŗĪŖĻ”ĮņĖį£©£¬øĆ×°ÖĆ¹¤×÷Ź±£¬MĪŖ_________¼«£ØĢī”°Õż”±»ņ”°øŗ”±£©£¬µ¼ĻßÖŠĶعż2 molµē×Óŗ󣬼Ł¶ØĢå»ż²»±äM¼«µē½āÖŹČÜŅŗµÄpH__________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£¬N¼«µē½āÖŹČÜŅŗ±ä»ÆµÄÖŹĮæ
×Ŗ»ÆĪŖĘųĢåČ¼ĮĻCO£Øµē½āÖŹČÜŅŗĪŖĻ”ĮņĖį£©£¬øĆ×°ÖĆ¹¤×÷Ź±£¬MĪŖ_________¼«£ØĢī”°Õż”±»ņ”°øŗ”±£©£¬µ¼ĻßÖŠĶعż2 molµē×Óŗ󣬼Ł¶ØĢå»ż²»±äM¼«µē½āÖŹČÜŅŗµÄpH__________£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£¬N¼«µē½āÖŹČÜŅŗ±ä»ÆµÄÖŹĮæ![]() __________g”£
__________gӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆ¹·ÓĖįõ„£ØMMF£©ŹĒĘ÷¹ŁŅĘÖ²ÖŠŅÖÖĘĻø°ūŌöÖ³×ī³£ÓƵÄŅ©Īļ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
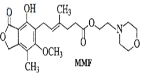
A. MMFÄÜČÜÓŚĖ®
B. 1mol MMFÄÜÓėŗ¬3 mol NaOHµÄĖ®ČÜŅŗĶźČ«·“Ó¦
C. MMF²»“ęŌŚĖ³·“Ņģ¹¹
D. 1mol MMFÄÜÓė6 mol H2·¢Éś¼Ó³É·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涔Ļ©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬æÉÓɶ”Ķé“ß»ÆĶŃĒāÖʱø”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Õż¶”Ķé£ØC4H10£©ĶŃĒāÖĘ1-¶”Ļ©£ØC4H8£©µÄČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
¢ŁC4H10(g)= C4H8(g)+H2(g) ¦¤H1
ŅŃÖŖ£ŗ¢ŚC4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ¦¤H2=-119 kJ”¤mol-1
O2(g)= C4H8(g)+H2O(g) ¦¤H2=-119 kJ”¤mol-1
¢ŪH2(g)+ ![]() O2(g)= H2O(g) ¦¤H3=-242 kJ”¤mol-1
O2(g)= H2O(g) ¦¤H3=-242 kJ”¤mol-1
·“Ó¦¢ŁµÄ¦¤H1ĪŖ________ kJ”¤mol-1”£Ķ¼£Øa£©ŹĒ·“Ó¦¢ŁĘ½ŗā×Ŗ»ÆĀŹÓė·“Ó¦ĪĀ¶Č¼°Ń¹ĒæµÄ¹ŲĻµĶ¼£¬x_____________0.1£ØĢī”°“óÓŚ”±»ņ”°Š”ÓŚ”±£©£»ÓūŹ¹¶”Ļ©µÄĘ½ŗā²śĀŹĢįøߣ¬Ó¦²ÉČ”µÄ“ėŹ©ŹĒ__________£ØĢī±źŗÅ£©”£
A£®ÉżøßĪĀ¶Č B£®½µµĶĪĀ¶Č C£®Ōö“óŃ¹Ēæ D£®½µµĶŃ¹Ēæ

£Ø2£©¶”ĶéŗĶĒāĘųµÄ»ģŗĻĘųĢåŅŌŅ»¶ØĮ÷ĖŁĶعżĢī³äÓŠ“߻ƼĮµÄ·“Ó¦Ę÷£ØĒāĘųµÄ×÷ÓĆŹĒ»ī»Æ“߻ƼĮ£©£¬³öæŚĘųÖŠŗ¬ÓŠ¶”Ļ©”¢¶”Ķ锢ĒāĘųµČ”£Ķ¼£Øb£©ĪŖ¶”Ļ©²śĀŹÓė½ųĮĻĘųÖŠn£ØĒāĘų£©/n£Ø¶”Ķ飩µÄ¹ŲĻµ”£Ķ¼ÖŠĒśĻß³ŹĻÖĻČÉżøßŗó½µµĶµÄ±ä»ÆĒ÷ŹĘ£¬Ęä½µµĶµÄŌŅņŹĒ___________”£
£Ø3£©Ķ¼£Øc£©ĪŖ·“Ó¦²śĀŹŗĶ·“Ó¦ĪĀ¶ČµÄ¹ŲĻµĒśĻߣ¬ø±²śĪļÖ÷ŅŖŹĒøßĪĀĮŃ½āÉś³ÉµÄ¶ĢĢ¼Į“ĢžĄą»ÆŗĻĪļ”£¶”Ļ©²śĀŹŌŚ590”ęÖ®Ē°ĖęĪĀ¶ČÉżø߶ųŌö“óµÄŌŅņæÉÄÜŹĒ___________”¢____________£»590”ęÖ®ŗ󣬶”Ļ©²śĀŹæģĖŁ½µµĶµÄÖ÷ŅŖŌŅņæÉÄÜŹĒ_____________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·°ļ®ļ®Ąė×Óµē³Ų¾ßÓŠ½Ļ“óµÄ±ČČŻĮ攢µĶĮ®µÄ¼ŪøńµČÓÅµć”£Ņ»ÖÖ·°ļ®ļ®Ąė×Ó¶ž“Īµē³ŲµÄ½į¹¹Ź¾ŅāĶ¼ČēĶ¼£¬Ęäøŗ¼«·“Ó¦ĪŖ£ŗCmLin-xe-=CmLin-x£«xLi+£ØCmLin±ķŹ¾ļ®Ō×ÓĒ¶ČėŹÆÄ«ŠĪ³ÉµÄø“ŗĻ²ÄĮĻ£©£¬·ÅµēŹ±µÄ×Ü·“Ó¦ĪŖ£ŗCmLin£«LiV3O8=CmLin-x£«Li1£«xV3O8”£
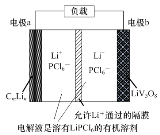
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.·ÅµēŹ±Li+ÓÉÕż¼«ĒųŅĘĻņøŗ¼«Ēų
B.³äµēŹ±µē¼«aÓėĶā½ÓµēŌ“µÄÕż¼«ĻąĮ¬
C.³äµēŹ±Ńō¼«ĪŖLi1£«xV3O8-xe-=LiV3O8£«xLi+
D.Õż¼«ÖŹĮæĆæŌö¼Ó2.1g£¬µēĀ·ÖŠ×ŖŅʵĵē×ÓŹżĪŖ0.1mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ¬¶ž“ĪĻõĖį£ØH2N2O2£©ŹĒŅ»ÖÖ¶žŌŖĖį£¬³£ĪĀĻĀ£¬ÓĆ0.01mol”¤L-1µÄNaOHČÜŅŗµĪ¶Ø10mL0.01mol”¤L-1µÄH2N2O2ČÜŅŗ£¬²āµĆČÜŅŗpHÓėNaOHČÜŅŗĢå»żµÄ¹ŲĻµČēĶ¼”£³£ĪĀĻĀ£¬ĻĀĮŠø÷µćĖł¶ŌÓ¦ČÜŅŗÖŠĪ¢Į£ĪļÖŹµÄĮæÅØ¶Č¹ŲĻµÕżČ·µÄŹĒ£Ø £©

A.aµć£ŗc(N2O22-)£«c(HN2O2-)-c(Na£«)=9.9”Į10-7mol”¤L-1
B.bµć£ŗc(Na£«)£¾c(N2O22-)£«c(HN2O2-)£«c(H2N2O2)
C.cµć£ŗc(Na£«)£¾c(HN2O2-)£¾c(N2O22-)£¾c(H2N2O2)
D.dµć£ŗ2c(H2N2O2)£«c(HN2O2-)£«c(H+)=c(OH-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ŌŚČżøöČŻ»żĻąĶ¬µÄŗćČŻĆܱÕČŻĘ÷ÖŠ°“²»Ķ¬·½Ź½Ķ¶ČėĪļÖŹ£¬·¢Éś·“Ó¦£ŗPCl3(g)£«Cl2(g)![]() PCl5(g) ¦¤H£¼0£¬²āµĆ·“Ó¦µÄĻą¹ŲŹż¾ŻČēĻĀ£ŗ
PCl5(g) ¦¤H£¼0£¬²āµĆ·“Ó¦µÄĻą¹ŲŹż¾ŻČēĻĀ£ŗ
ČŻĘ÷1 | ČŻĘ÷2 | ČŻĘ÷3 | |
ĪĀ¶Č/”ę | 200 | 300 | 200 |
ĘšŹ¼ĪļÖŹĶ¶ČėĮæ | 1molPCl3”¢2molCl2 | 2molPCl3”¢1molCl2 | 2molCl2”¢2molPCl5 |
Ę½ŗāc(PCl5)/mol”¤L-1 | c1 | c2 | c3 |
»ÆŃ§Ę½ŗā³£Źż | K1 | K2 | K3 |
Ę½ŗāĢåĻµ×ÜŃ¹Ēæp/Pa | p1 | p2 | p3 |
ĪļÖŹµÄ×Ŗ»ÆĀŹ¦Į | ¦Į1(PCl3) | ¦Į2(Cl2) | ¦Į3(PCl5) |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.K1£¼K2
B.c1£¼c2
C.p3=2p1
D.¦Į1(PCl3)£«¦Į3(PCl5)£¼1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĮæµÄŠæÓė100 mL 18.5 mol”¤L£1µÄÅØĮņĖį³ä·Ö·“Ó¦ŗ󣬊æĶźČ«Čܽā£¬Ķ¬Ź±Éś³ÉĘųĢå¼×33.6 L(±ź×¼×“æö)”£½«·“Ó¦ŗóµÄČÜŅŗĻ”ŹĶÖĮ1 L£¬²āµĆČÜŅŗµÄc(H+£©=0.1 mol”¤L£1”£ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ( )
A. ·“Ó¦ÖŠ¹²ĻūŗÄ1.8 mol H2SO4B. ĘųĢå¼×ÖŠSO2ÓėH2µÄĢå»ż±ČĪŖ4”Ć1
C. ·“Ó¦ÖŠ¹²ĻūŗÄ97.5 g ZnD. ·“Ó¦ÖŠ¹²×ŖŅĘ3 molµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫4molAŗĶ2molBŌŚ2LµÄĆܱÕČŻĘ÷ÄŚ»ģŗĻ£¬²¢ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗ2A£Øs£©+B£Øg£©2C£Øg£©£¬Čō¾2sŗó²āµĆCµÄÅضČĪŖ0.6mol”¤L-1£¬ĻÖÓŠĻĀĮŠ¼øÖÖĖµ·Ø£ŗ¢ŁÓĆĪļÖŹA±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ0.3mol”¤L-1”¤s-1¢ŚÓĆĪļÖŹB±ķŹ¾µÄ·“Ó¦µÄĘ½¾łĖŁĀŹĪŖ0.6mol”¤L-1”¤s-1¢Ū2sŹ±ĪļÖŹAµÄ×Ŗ»ÆĀŹĪŖ30%¢Ü2sŹ±ĪļÖŹBµÄÅضČĪŖ0.7mol”¤L-1ĘäÖŠÕżČ·µÄŹĒ£Ø £©
A. ¢Ł¢ŪB. ¢Ł¢ÜC. ¢Ś¢ŪD. ¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com