
| A. | CH4、C2H4、C3H4 | |
| B. | CH4、C3H8、C2H2(C2H8、C2H2物质的量之比为1:3) | |
| C. | C2H6、C4H6、C2H2(物质的量之比为2:1:2) | |
| D. | C3H8、C4H8、C2H2(质量之比为11:14:26) |
分析 200℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则反应前后气体总化学计量数不变,据此计算判断.
解答 解:200℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(g),完全燃烧前后气体体积没有变化,则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,故y=4,
A、CH4、C2H4、C3H4,氢气子数都是4,所以完全燃烧前后气体体积没有变化,故A正确;
B、C2H8、C2H2物质的量之比为1:3,所以氢平均为:$\frac{8×1+2×3}{1+3}$=$\frac{7}{2}$,氢平均小于4,所以体积一定变化,故B错误;
C、C2H6、C4H6、C2H2(物质的量之比为2:1:2),所以氢平均为:$\frac{2×6+6+2×2}{5}$=$\frac{22}{5}$,氢平均大于4,所以体积一定变化,故C错误;
D、C3H8、C4H8、C2H2(质量之比为11:14:26),所以物质的量之比为:$\frac{11}{44}:\frac{14}{54}:\frac{26}{26}$=1:1:4,所以氢平均为:$\frac{8+8+2×4}{6}$=4,所以氢平均等于4,所以反应前后气体总化学计量数不变,故D正确;
故选AD.
点评 本题考查烃燃烧耗氧量、生成气体体积的变化的问题,难度不大,注意对规律的理解与掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 9种 | C. | 11种 | D. | 13种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
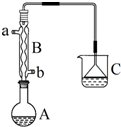 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molC2H4所含的电子数为12 NA | |
| B. | 标准状况下,16g甲烷中共价键数目为4NA | |
| C. | 常温常压,4 g氦气所含的核外电子数为4NA | |
| D. | 标准状况下,22.4L NO 与11.2L O2 充分反应后,所得的气体分子数一定为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com