
 ,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
,分子的立体构型为V型,中心原子的杂化轨道类型为sp3杂化.
分析 X、Y、Z、R、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图1所示,Y、Z的单质是空气的主要成分,且Y的原子半径大于Z,同一周期元素中,元素的原子半径随着原子序数的增大而减小,所以Y是N元素、Z是O元素,R、W的原子半径大于Z,所以R、W是第三周期元素,W的原子半径在同周期主族元素中最小,所以W是Cl元素,R的原子半径在同周期主族元素中最大,所以R为Na元素,X的原子半径最小,则X是H元素,再结合原子结构、物质的性质解答.
解答 解:X、Y、Z、R、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图1所示,Y、Z的单质是空气的主要成分,且Y的原子半径大于Z,同一周期元素中,元素的原子半径随着原子序数的增大而减小,所以Y是N元素、Z是O元素,R、W的原子半径大于Z,所以R、W是第三周期元素,W的原子半径在同周期主族元素中最小,所以W是Cl元素,R的原子半径在同周期主族元素中最大,所以R为Na元素,X的原子半径最小,则X是H元素,
(1)W是Cl元素,其价电子排布式为3s23p5,故答案为:3s23p5;
(2)化合物HClO为共价化合物,氧原子和氢原子、氯原子之间都存在一个共用电子对,所以HClO的电子式为 ,HClO分子中O原子电子对数为$\frac{6+2}{2}$=4,属于sp3杂化,分子形状为V型,
,HClO分子中O原子电子对数为$\frac{6+2}{2}$=4,属于sp3杂化,分子形状为V型,
故答案为: ;V型;sp3杂化;
;V型;sp3杂化;
(3)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,Na属于金属元素,第一电离能最小,所以第一电离能N>O>Na,故答案为:N>O>Na.
(4)由Cl、N两种元素组成的一种化合物M分子中,每个原子最外层均达到稀有气体的稳定结构,则该物质为NCl3,在工业生产中M大规模用于面粉的漂白和杀菌,则该物质和水反应生成HClO,根据元素守恒知,还生成NH3,则M与水反应的化学方程式:NCl3+3H2O=NH3+3HClO,
故答案为:NCl3+3H2O=NH3+3HClO;
(5)N3-中原子个数是3,价电子数是3×5+1=16,则与N3-互为等电子体的分子为:N2O或CO2、CNO-,N3-中价层电子对=2+$\frac{1}{2}$(5+1-2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线形,
故答案为:N2O;CNO-;直线形;
(6)Na属于体心立方堆积方式,即为图B,其晶胞空间利用率为68%,NaCl晶胞中阴、阳离子的周围分别有6个等距离子,故其配位数为6,晶胞中的阴离子Cl-位于晶胞中顶点和面心,故其堆积方式与图2中的D相似,
故答案为:B;68%;6;D.
点评 本题考查了原子核外电子排布、分子空间构型、杂化方式、元素电离能及电负性的含义、晶胞的计算等问题,中等难度,解题时注意基础知识的灵活运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
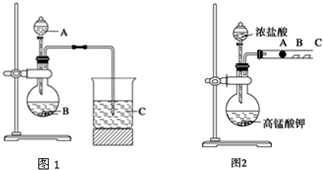
 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
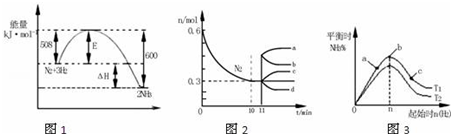
| A. | 由图1可知2NH3(g)?N2(g)+3H2(g)△H=-92kJ•mol-1 | |
| B. | 图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | |
| C. | 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | |
| D. | 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF2Cl只有一种结构 | B. | 三根B-F键间键角都为120° | ||
| C. | BFCl2只有一种结构 | D. | 三根B-F键键长都为130pm |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物分子式为 C10H10O4 | |
| B. | 1mol该有机物与 H2发生加成时最多消耗H2 5 mol | |
| C. | 1mol该有机物与足量溴水反应时最多消耗Br23 mol | |
| D. | 1mol该有机物与 NaOH 溶液反应是最多消耗NaOH 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中龠Na+,不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加 少量氯水,溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| C | 向苯中滴入少量浓溴水,振荡,精置分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na+,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com